A propósito del hilo en el Foro Facoelche iniciado por la Dra. Saskia Sánchez, en referencia a la reciente comercialización de la povidona iodada al 0.6% y sus posibles indicaciones aún no aprobadas, hemos decidido elaborar el siguiente FacoBlog sobre el uso de la povidona iodada en Oftalmología basado en la evidencia, así como las hipótesis que se plantean en base a la evidencia existente.
INTRODUCCIÓN Y ANTECEDENTES
Antes de hablar directamente de la povidona iodada como sustancia desinfectante, destacaremos que los desinfectantes se pueden clasificar en tres niveles dependiendo del espectro de actividad antimicrobiana(1):
- Desinfectantes de alto grado: se utilizan para la esterilización de instrumentos médicos exclusivamente.
- Desinfectantes de grado medio: la PI se sitúa en este rango. Se emplea para la desinfección de la piel. Es efectivo frente a bacterias multirresistentes, tales como la Pseudomona aeruginosa, Mycobacterium tuberculosis, hongos, virus de la hepatitis, biofilms y Acanthamoeba, siendo inefectivos frente a las esporas.(2)
- Desinfectantes de bajo grado: la clorhexidina se sitúa en este grupo. La actividad antimicrobiana incluye bacterias no resistentes de pseudomona aeruginosa y hongos, siendo ineficaces frente a mycobacterium tuberculosis, virus de la hepatitis o esporas.
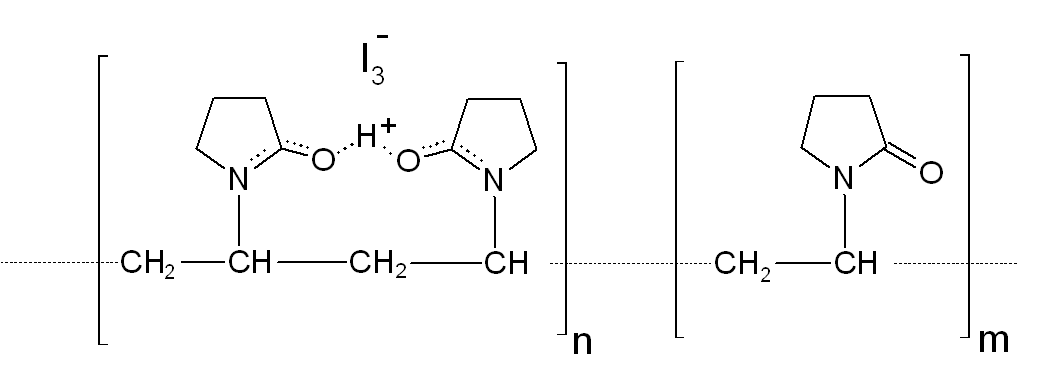
Históricamente, el iodo en su forma de tinción iodada se ha utilizado durante más de un siglo como antiséptico. Sin embargo, a pesar de su eficacia, su uso ha estado en gran parte comprometido por sus numerosos efectos secundarios, tales como quemazón, irritación, y alergias. La iodopolivinilpirrolidona (PVP-I), comúnmente conocida como povidona iodada (PI), se desarrolló a principios de 1950 y se compone de dos átomos de iodo (diiodo) y polivinilpirrolidona (povidona). Es un polímero hidrosoluble que actúa como portador del iodo cuya solubilidad en el agua depende de la longitud de la cadena de la PI entre el 5% (tipo 90/04, peso molecular medio de 1 000 000) y más de 20% (tipo 17/12, peso molecular medio cerca de 10 000). (3)
La PI se puede presentar en soluciones suspendidas en forma de hidrogel, como polivinil alcohol, carboximetil celulosa, gelatina, y poliacrilamida cross-linkada. La presentación en forma de hidrogel se suele usar para las heridas de la piel. La tasa de liberación del iodo depende de su estructura química y de la concentración del compuesto iodo-hidrogel. (4)
La PI ha demostrado una actividad de amplio espectro contra bacterias, hongos, y virus y protozoos.(5–7) Igualmente, la PI ha demostrado ser un agente desinfectante y antiséptico, que generalmente se usa en el preoperatorio sobre la piel y mucosas, así como para el tratamiento de las heridas contaminadas.(4) El iodo oxida el agua, liberando iones que son los responsables de los efectos viricidas y bactericidas sobre la membrana celular.(8) Como el iodo también puede actuar sobre las células normales del cuerpo humano, se precisa de un equilibrio entre una concentración efectiva y a la vez no tóxica, siendo el tiempo de exposición también crucial.(9) La capacidad viricida de la PI fue demostrada mediante Sriwilaijaroen y col. al observar que la PI inhibía la hemaglutinina y neuraminidasa en el virus de la influenza mediante un mecanismo de inhibición mixto(10) consistiendo esta, en que el inhibidor se puede unir tanto a la enzima libre como al complejo enzima-sustrato. El inhibidor, en este caso la PI, se une a un lugar distinto del sitio activo en el que se une el sustrato.
Además, es sabido que la PI presenta una actividad multimodal frente a patógenos mediante su capacidad de oxidación de determinadas estructuras como los aminoácidos, nucleótidos y componentes de la membrana celular.(11,12) La observación del comportamiento de la PI mediante microscopía electrónica y análisis bioquímicos ratifican la interacción de la PI con la membrana celular de los microrganismos citados, formando poros o generando una interfaz sólido-líquida a nivel de la membrana lipídica, llevando a la desestructuración del citosol y desnaturalización enzimática.(13)
Dichas propiedades de la PI mencionadas constituyen la base de su amplio espectro, ausencia de resistencias, su capacidad para penetrar en biofilms, una reducida citotoxicidad hacia las células del huésped, su coste/efectividad, y, en consecuencia, un perfil favorable de riesgo/beneficio.(11)
Por consiguiente, no es de sorprender que la PI se ha usado, y se usa comúnmente para la esterilización de la superficie ocular previa a cirugía en la oftalmología.
CONCENTRACIÓN IDÓNEA Y TIEMPO DE EXPOSICIÓN NECESARIO
Los primeros estudios sobre la aplicación de PI diluida sobre el saco conjuntival datan de los años 1960.
Cómo se ha mencionado antes, según la guía de la ESCRS, la concentración recomendada es entre el 5 y el 10%, aunque no existe consenso sobre este aspecto.14 La escuela americana usa las mismas guías y recomendaciones.(15) En cambio, otros países como China y Japón emplean menores concentraciones de PI de manera rutinaria. Shimada y col. recomiendan emplear una concentración de PI al 1.25% en el preoperatorio. (16)
Un estudio de autores chinos con una muestra de 59392 procedimientos observó que la irrigación con PI al 0.5% reducía el riesgo de endoftalmitis postoperatoria.(17)
Berkelman y col. afirmó que concentraciones más bajas de PI resultaban en niveles aumentados de iodo libre, y por ello pudiera manifestar una actividad bactericida mayor.(18)
Al aislar los microorganismos de pacientes con endoftalmitis y estudiar su comportamiento in-vitro, se evidenció que las pautas más efectivas eran la PI al 5% durante 15 minutos, y al 10% durante 5 minutos. Además, la PI al 10% durante 1 minuto era efectiva en erradicar todas las especies bacterianas exceptuando Staphylococcus epidermidis, que requirió un mínimo de 5 minutos de exposición de PI al 10%.(19) Sin embargo, Silas y col. reportaron que el uso de PI al 2.5% o mayor era efectiva en eliminar Staphylococcus epidermidis con una única instilación, aunque el uso de la PI al 0.7% o mayor era igual de efectiva cuándo es instilada 3 veces cada 30 segundos. Los autores recomiendan el uso repetido de la PI al 1% durante el preoperatorio, afirmando que esta provoca una menor irritación de la superficie ocular.(20)

La concentración de iodo libre en una solución de PI al 10% es de 5 partes por millón (ppm), en PI al 1% es de 13 ppm y en PI al 0.1% 24 ppm. Por esta razón, el tiempo para erradicar una bacteria parece ser menor en las concentraciones de PI entre 0.1%-1% (tiempo medio 15s) comparado a la PI al del 2.5%-10% (entre 30-120s).(18)
Dicho de otra forma, soluciones de PI a concentración <1% han supuesto el máximo contenido de iodo libre bactericida.(18,21) Se estima que la concentración de la solución de PI será aún más diluida con la lágrima residual en el fondo de saco conjuntival al instilar una gota de ella, de manera que una gota de PI al 0.6% tendrá una concentración efectiva del 0.1%.(22) Varios estudios in vitro han demostrado la eficacia antimicrobiana de una solución oftálmica de povidona iodada al 0,6%, que exhibió una actividad bactericida más rápida que la solución tradicional de PI al 5%.(23,24)
Tras reaccionar el iodo libre con la materia orgánica, este se inactiva y debe ser repuesto para continuar con la acción bactericida. A concentraciones entre el 2.5%-10%, la elevada concentración permite que exista una reserva de iodo libre potencialmente disponible cuando esta se agote, precisando de pocas o una sola instilación. A concentraciones más bajas, tales como del 0.1%-1%, el efecto bactericida se agota rápidamente y por ello se precisa de mayor número de instilaciones.(18) Por lo tanto, aunque la PI a concentraciones del 2.5-10% precisan de mayor tiempo para alcanzar la máxima capacidad bactericida, su actividad residual es también mayor. Estas concentraciones elevadas (2.5-10%) de PI se recomiendan en situaciones dónde una sola instilación es suficiente, como para la desinfección palpebral o periocular, así como en el preoperatorio de cirugía de cataratas.(4)
Se ha hipotetizado que la irrigación prolongada y volúmenes mayores de PI pueden llegar a desinfectar efectivamente las criptas conjuntivales, especialmente aquellas localizadas en el fórnix conjuntival, situación que no ocurre con una instilación de una sola gota de PI. Esto podría ayudar a reducir la presencia de biofilms bacterianos que acaparan bacterias.(7)
Existe una falta de consenso sobre el tiempo de exposición necesario de la PI al 5% en procedimientos intraoculares. Una de las razones para ello es que es difícil conocer con exactitud cuánto dura una gota de PI sobre la superficie ocular. El número de instilaciones puede que sea más importante que la duración de una sola gota en sí, ya la frecuencia si puede ser controlada.(22) Existen diferencias en las recomendaciones de tiempo de antisepsia previa ITV versus cirugía de cataratas. En el primer caso, se recomienda un tiempo mínimo de 30 segundos, mientras que en el segundo caso es de 3 minutos. Friedman y col. observaron que un tiempo de 15s de PI al 5% no era suficiente para reducir la concentración de unidades formadoras de colonias (UFC), y por ello recomendando un mínimo de 30 segundos.(25)
Recientemente, Reibaldi y col. evaluaron en un ensayo clínico aleatorizado (no ciego) la reducción en el número de UFC en el fondo de saco conjuntival en pacientes naïve que iban a ser tratados con anti-VEGF que fueron tratados con PI al 0.6% 3 veces al día 3 días antes de la inyección en comparación con el grupo control que fueron tratados con placebo.(22) Además, se evaluó la tasa de contaminación de las agujas tras la inyección en ambos grupos. El tamaño muestral del estudio era de 507pacientes (254 en el grupo tratado y 253 en el grupo control). Se tomaron muestras con hisopos del fondo de saco conjuntival antes de empezar con el tratamiento, el día de la inyección e inmediatamente antes de ser intervenidos. Justo antes de ser intervenidos, los pacientes se sometieron al protocolo estandarizado de preparación del campo quirúrgico con PI al 10% e instilación de PI al 5% en fondo de saco conjuntival. Los autores observaron una reducción estadísticamente significativa de la UFC conjuntivales en el grupo tratado (82%) con PI al 0.6%, mientras que el grupo control no se evidenciaron cambios. En cuanto a la contaminación de las agujas, ninguna de ellas fue positiva a bacterias en el grupo tratado, mientras que el grupo control si mostró positividad a bacterias en 6 agujas. Las bacterias más frecuentemente detectadas, como ya se ha reportado en la literatura, eran Staphylococcus coagulasa negativos. No se experimentó ningún caso de endoftalmitis en ninguno de los grupos.(22)
Los autores recalcaron que, dado que más del 90% de las inoculaciones bacterianas ocurren en el momento de la inyección intravítrea debido a la contaminación de las agujas con la superficie conjuntival, la reducción de la carga bacteriana conjuntival permitiría disminuir hipotéticamente el riesgo de endoftalmitis.(26)
La limitación principal del estudio es que no se evaluó la tasa de endoftalmitis entre ambos grupos. Sin embargo, dada la rareza de este evento, el tamaño muestral necesario sería bastante mayor. Por otra parte, el perfil de seguridad de la PI al 0.6% sumado a la evidencia de la reducción de la carga bacteriana y de la contaminación de las agujas que se demuestra en este estudio, constituyen un primer paso hacia el camino de la evidencia de si la PI al 0.6%, o en su defecto, una solución de PI de concentración más baja que la estandarizada (5%), pudiera ser un tratamiento profiláctico viable para la endoftalmitis previa a las ITV.(22)
TOXICIDAD Y EFECTOS ADVERSOS
El uso de PI en a la cirugía del segmento anterior tiene como principal limitación la toxicidad epitelial corneal. La gravedad de la toxicidad epitelial se correlaciona directamente con la concentración de PI, siendo mayor en pacientes que han recibido PI al 5% comparado con PI al 2.5%, 1% y 0.5%.(27)
Estudios en animales también han demostrado una toxicidad endotelial tras el uso de PI al 0.25%, causando cambios morfológicos endoteliales y edema corneal.(28) Además, dichos experimentos sobre animales estudiaron los efectos de PI inyectada en cámara anterior (CA). Los cambios mencionados eran transitorios, y a los 14 días se evidenciaba una recuperación completa. Los autores señalaron la importancia de conocer este dato, puesto que la PI utilizada preoperatoriamente puede accidentalmente entrar en la CA a través de las incisiones corneales.(28)
Otros estudios sobre animales (conejos) observaron ninguna toxicidad endotelial tras la inyección de PI en la CA.(29) Sin embargo, es de destacar que el endotelio de los conejos tiene una alta capacidad regenerativa. Por ello, debemos tener presente, especialmente durante la preparación de una córnea donante, la toxicidad endotelial de la PI, especialmente en pacientes mayores y/o aquellos con una densidad de células endoteliales reducidas.
Entre los efectos secundarios sistémicos, Chabrolle y Rosier reportaron hipotiroidismo y bocios transitorios en pacientes pediátricos cuya piel fue tratada con soluciones yodadas.(30) Este hecho no se ha reportado por ningún otro autor.
Las alergias a la PI o al yodo si constituyen un problema más prevalente que los efectos secundarios sistémicos. Las verdaderas alergias son raras. En estos casos, se suele optar por la clorhexidina al 0.05%.(14) No existe ninguna publicación en la literatura que haya reportado resistencia o anafilaxis a la PI. El dolor post-ITV es común, y se suele atribuir a la sensibilidad química (no alergia) de la PI en contacto con la superficie ocular (sobre todo en concentraciones de PI entre 5-10%).(31)
RESISTENCIA BACTERIANA
Una gran proporción de distintas cepas de staphylococco coagulasa-negativos pueden poseer distintos perfiles y susceptibilidades a antibióticos.(32) A pesar de que algunos cultivos conjuntivales pueden mostrar mayor resistencia a antibióticos que otras aún no se ha reportado ninguna resistencia a la PI. Además, la exposición repetida a antibióticos tópicos previa a las ITV incrementa significativamente la resistencia de las cepas bacterianas de la flora conjuntival a dichos antibióticos.(33) Esto se ha demostrado con aumento de tasas de resistencia a moxifloxacino y gatifloxacino tan altas como hasta el 70% de pacientes que se someten a ITV y profilaxis antibiótica tras 1 año de la práctica de dicha profilaxis.(34)
Tras la exposición repetida a la PI, no se ha demostrado una alteración significante de la flora conjuntival normal, ni la aparición de resistencia bacteriana a antibióticos, incluyendo fluoroquinolonas y azitromicina.(35)
USOS EN OFTALMOLOGÍA
1. Profilaxis de endoftalmitis en cirugía de cataratas.
La aplicación de PI sobre los párpados, pestañas y conjuntiva previa a la cirugía intraocular reduce el riesgo de endoftalmitis.(4)
Es sabido que los cultivos bacterianos de muestras vítreas en pacientes con endoftalmitis postquirúrgica son positivas a especies de la flora conjuntival o palpebral.(4) Por ello, uno de los objetivos en la profilaxis contra la endoftalmitis postquirúrgica es la reducción de la carga bacteriana palpebral y conjuntival. La cirugía más estudiada en la profilaxis de la endoftalmitis es la cirugía de cataratas, puesto que es la cirugía más prevalente en la especialidad oftalmológica.(4) Mazoteras y col. enfatizan el hecho de que es posible que se produzca una proliferación bacteriana sobre la óptica de las lentes intraoculares a largo plazo en ojos intervenidos mediante cirugía de cataratas no complicadas y con ausencia de clínica o síntomas.(36) Por ello, la antisepsia perioperatoria parece ser tan importante como reducir la carga bacteriana al máximo posible.
El uso de la PI en el protocolo de antisepsia prequirúrgica es una medida estandarizada y ha demostrado reducir el riesgo de endoftalmitis.(37) Los aspectos más importantes en la metodología de la profilaxis incluyen la dosis, el tiempo de actuación y la concentración de la PI en la aplicación conjuntival de la PI.(4) Además, también es interesante conocer el impacto de la aplicación de la PI sobre los párpados.(4)
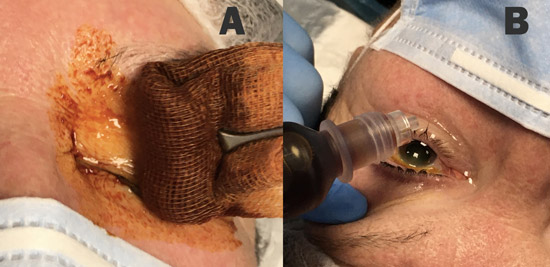
La antisepsia sobre la superficie ocular con PI es la única que ha logrado demostrar un nivel II de evidencia en la reducción de la tasa de endoftalmitis.(38) Según las guías del European Society of Cataract and Refractive Surgery (ESCRS), la solución de PI del 5-10% debe ser aplicado sobre la córnea, saco conjuntival y piel periocular durante un mínimo de 3 a 5 minutos antes de la cirugía.(14) Además, también se recomienda la desinfección del campo quirúrgico periorbitario con PI.
Wu y cols. afirmaron que la desinfección de la piel con PI al 10% resultó en una incidencia disminuida de endoftalmitis en comparación con PI al 5%.(39) Sin embargo, el poder estadístico de los resultados fue cuestionable.
El uso de PI de manera aislada es suficiente para reducir la carga bacteriana y la asociación a un antibiótico tópico preoperatorio no influencia la reducción de la carga.(40) No existe evidencia sobre el uso de antibiótico en el preoperatorio, y muchos autores señalan además el aumento de la tasa de la resistencia antibiótica, insistiendo por ello abandonar el uso del antibiótico preoperatorio.(4)
Recientemente, Eslami y col.(41) llevaron a cabo un ensayo clínico aleatorizado de 142 pacientes que estaban programados para cirugía de cataratas. El grupo de estudio recibió PI al 10% sumado a levofloxacino al 0.5% (3 gotas) una hora antes de la intervención. El grupo control sólo recibió PI al 10% (3 gotas) una hora antes de la intervención. Posterior e inmediatamente antes de la intervención, ambos grupos recibieron otra dosis de PI al 10% (3 gotas). Se establecieron tres tiempos en la recogida de muestras del fondo de saco conjuntival: T1 (antes de instilar el tratamiento), T2 (antes de la segunda instilación de PI), T3 (3 minutos después de la segunda instilación de PI), y T4 (justo después de la cirugía).
El objetivo primario era comparar la colonización bacteriana mediante cultivos del fondo de saco conjuntival en los distintos tiempos en ambos grupos de tratamiento. Los autores encontraron diferencias estadísticamente significativas en el número de cultivos positivos a bacterias en T3 (7% en el grupo estudio y 19.7% en el grupo control), concluyendo que la asociación de PI al 10% y levofloxacino al 0.5% aumentaba la esterilidad conjuntival en el preoperatorio inmediato. Entre las limitaciones del estudio, los autores no contabilizaron el número de bacterias (UFC), sino más bien objetivaron cualitativamente la positividad del cultivo. Además, no se encontraron diferencias estadísticamente significativas en la positividad de los cultivos en el postoperatorio inmediato (T4), siendo del 5.6% para el grupo de estudio y 4.2% para el grupo control.
2. Profilaxis de endoftalmitis previo a Inyecciones Intravítreas (ITV)
Durante años, el uso de antibióticos tópicos de manera empírica había sido la norma aceptada en la profilaxis de la endoftalmitis tras inyecciones intravítreas (ITV).(42) En cambio, la evidencia actual apunta a que el uso rutinario de antibióticos tópicos en este contexto es perjudicial al aumentar la resistencia a dichos antibióticos.(43) El lavado con PI sobre la conjuntiva y la superficie ocular es mandatorio en las medidas antisépticas previa a ITV. (4)
Modjatehedi y col. reportaron una incidencia del 9.4% (5 pacientes de 53) de endoftalmitis en pacientes que no se sometieron al lavado con PI previa a ITV debido a alergia al iodo, en comparación con el grupo que sí lo recibió.(44)
Cheung. y col. reportaron una mayor incidencia de endoftalmitis post ITV en pacientes que recibieron antibióticos tópicos asociados a PI, en comparación con aquellos a los que sólo fue aplicada la PI previa a la ITV, en un estudio con un tamaño muestral grande en que se realizaron 15.895 procedimientos.(45) Por este motivo, evitar el uso de antibióticos tópicos previa a la administración de ITV parece ser reconocido.
Sin embargo, la antisepsia con PI no reduce a cero el riesgo de endoftalmitis tras la terapia intravítrea, ya que la incidencia de esta infección después de la aplicación de PI varía entre 0,02% y 0,3% y la tasa acumulada registrada a lo largo de las series de tratamientos es de hasta el 1% de los pacientes.(22)
3. Profilaxis de endoftamlitis y otras infecciones previo a cirugía de vítreo-retina.
El uso de PI también es una práctica obligatoria previa a la vitrectomía. Shimada y col. observaron en un estudio de 4347 ojos, los efectos del lavado conjuntival con PI al1.25% en comparación con otro grupo que sólo fue lavado con BSS previa cirugía de VPP 25G.No se evidenció endoftalmitis en ninguno de los grupos. Sin embargo, había más cultivos positivos a bacterias en el grupo que no recibió PI al 1.25%.(16)
En otro estudio del mismo grupo, se empleó PI al 0.25% previa cirugía de cerclaje escleral. Los autores concluyeron que esta medida profiláctica redujo la cantidad de UFC, y por ello, puede ser potencialmente beneficioso en reducir la incidencia de infecciones asociados a la banda del cerclaje.(46)
4. Profilaxis de endoftalmitis en trasplante de córnea.
Lindquist y col. estudiaron la influencia de la exposición de PI al 1% y al 5% sobre la conjuntiva en donantes de córnea. No se observó ninguna diferencia en la cantidad de UFC, aunque la toxicidad epitelial era mayor en el grupo de la PI al 5%.(47)
El uso de una solución de PI al 1%, por ello, se recomienda previa extracción de córnea donante, logrando reducir el riesgo de endoftalmitis e intentando preservar un epitelio sano.
5. Oftalmía Neonatal (Conjuntivitis del recién nacido)
El uso de la PI para el tratamiento de infecciones bacterianas o su profilaxis se ha estudiado sobre todo en países en vías de desarrollo, dónde la disponibilidad de antibióticos tópicos es limitada. La conjuntivitis del recién nacido era la causa principal de ceguera durante el siglo XIX en Europa. La instilación de una solución de nitrato de plata en el saco conjuntival reducía significantemente la incidencia de esta complicación. Actualmente, en varios países, el nitrato de plata se ha sustituido por preparaciones de eritromicina o tetraciclinas debido a su actividad antibacteriana contra Chlamydia trachomatis y menor toxicidad que el nitrato de plata.(48)
Existen numerosos estudios que han estudiado el uso de PI como profilaxis contra la oftalmía de la infancia en comparación con el nitrato de plata , pomada de eritromicina pomada de tetraciclinas y pomada de cloranfenicol.(4) Isenberg y col. demostró que la PI al 2.5% era más efectiva que el nitrato de plata o eritromicina en 100 pacientes, además de ser menos tóxica.49Estos datos han sido ratificados en un ensayo de 3117 recién nacidos en Kenya.(49) Además, existe una ventaja económica y de provisión de esta medicación, ya que es más barata y su presentación en forma deshidratada (en polvo) hace que su transporte y disponibilidad en países en vías de desarrollo sea más factible.(50)
Khan y col. reportaron que la PI al 1.25% lograba reducir las UFC de manera igual de efectiva que la PI al 2.5% en recién nacidos.(51) Además, la PI al 2.5% puede ser más tóxico para la superficie ocular.(4)
6. Queratitis infecciosas
Este grupo de enfermedades supone una de las causas más frecuentes de ceguera en países en vías de desarrollo y del tercer mundo. La población de mayor riesgo lo constituyen los pacientes pediátricos, siendo la cicatrización corneal la causa más frecuente de ceguera evitable en niños en el mundo.
Isenberg y col. compararon el uso de PI al 1.25% con antibióticos comúnmente disponibles en países del tercer mundo en pacientes pediátricos y adultos hospitalizados y además diagnosticados de queratitis infecciosa. Para las queratitis bacterianas, la PI se comparó con la neomicina-poliximina B-gramicidina en una población de Filipinas, y en otro grupo de pacientes de la India con ciprofloxacino al 0.3%. No se encontraron diferencias estadísticamente significativas entre el uso de PI al 1.25% y los antibióticos citados.(52)
7. Conjuntivitis adenovírica
Actualmente no existe indicación de PI a ninguna concentración para el tratamiento de la conjuntivitis adenovírica. Sin embargo, existen varios estudios in vitro que han demostrado la efectividad de la PI frente al adenovirus.(53,54) Se ha observado que la PI a una concentración del 0.8% puede erradicar completamente la carga de adenovirus libre tras un tiempo de exposición de 10 minutos, si bien no es efectiva frente a las células ya infestadas por dicho virus. Estudios en humanos han demostrado el perfil de seguridad y tolerabilidad de la PI para el tratamiento de la conjuntivitis adenovírica.(55,56)
Un ensayo clínico aleatorizado reportó que pacientes tratados con PI al 0.5% 3 veces al día asociado a lágrimas artificiales lograron una recuperación media 2 semanas más rápida en comparación con el grupo control que fue tratado sólo con lágrimas artificiales.(57)
Ozen Tunay y col. evaluaron el efecto de la PI al 2.5% en pacientes pediátricos observando también una recuperación más rápida comparado con el control.(58) Pepose y col(59) y otros estudios(7) han demostrado seguridad, tolerabilidad y una resolución más temprana de la conjuntivitis en pacientes que recibieron una combinación de PI al 0.6% y dexametasona al 0.1% comparado con los grupos controles.
CONCLUSIÓN
El uso de la PI en la oftalmología supone uno de los pilares fundamentales en la profilaxis de una de las complicaciones más severas, aunque agraciadamente infrecuente, como es la endoftalmitis. Además, su uso aislado sin asociar antibiótico es fundamental para evitar el aumento de la resistencia de éstas.
La limitación principal de la PI es la toxicidad corneal, especialmente la epitelial, que es directamente proporcional a la concentración de la solución de PI. Además, concentraciones más bajas de PI parecen tener un mayor efecto bactericida y viricida inmediato al disponer de más iodo libre, a expensas de un menor tiempo de actuación y por tanto necesitando de una mayor posología.
Conocer las propiedades de la PI ha permitido que surjan numerosos estudios evaluando distintas concentraciones de PI menores que la estandarizada (5%) en un intento de demostrar una no-inferioridad en la tasa de endoftalmitis. Es importante recalcar que esto aún no se ha demostrado. Sin embargo, sí se ha podido demostrar la seguridad, tolerabilidad del paciente, la reducción de la carga bacteriana de la superficie ocular, y la menor tasa de contaminación de la aguja que se emplea como fungible para la inyección intravítrea. Estas últimas sí son factores de riesgo conocidos para desarrollar una endoftalmitis.
REFERENCIAS
- Garner JS, Favero MS. CDC guidelines for the prevention and control of nosocomial infections. Guideline for handwashing and hospital environmental control, 1985. Supersedes guideline for hospital environmental control publishedin 1981. Am J Infect Control 1986; 14:110–129.
- Grzybowski A, Brona P. Povidone-iodine is still a premium antiseptic measure ocular surgery. Acta Ophthalmol [Internet] 2017; 95:e253–e254; Available from: http://dx.doi.org/10.1111/aos.13144.
- Gottardi W. Iodine and iodine compounds. In: Block SS, ed. Disinfection, Sterilization, and Preservation. Philadelphia, London: Lea & Febinger; 1991. pp. 152–166.
- Grzybowski A, Kanclerz P, Myers WG. The use of povidone-iodine in ophthalmology. Curr Opin Ophthalmol. 2018 Jan;29(1):19-32. doi: 10.1097/ICU.0000000000000437. PMID: 28984794.
- Zamora JL. Chemical and microbiologic characteristics and toxicity of povidone-iodine solutions. Am J Surg 1986; 151: 400–406.
- Benevento WJ, Murray P, Reed CA, et al. The sensitivity of Neisseria gonorrhoeae, Chlamydia trachomatis, and herpes simplex type II to disinfection with povidone-iodine. Am J Ophthalmol 1990; 109: 329–333
- Edington M, Ramaesh K, Lockington D. Virucidal benefits of povidone-iodine use on the ocular surface: a review. BMJ Open Ophthalmology 2020;5:e000509. doi:10.1136/ bmjophth-2020-000509
- Shelanski HA, Shelanski MV. PVP-iodine: history, toxicity and therapeutic uses. J Int Coll Surg 1956; 25:727–734.
- Shimada H, Nakashizuka H, Grzybowski A. Prevention and treatment of postoperative endophthalmitis using povidone-iodine. Curr Pharm Des. 2017; 23:574–585.
- Sriwilaijaroen N, Wilairat P, Hiramatsu H, et al. Mechanisms of the action of povidone-iodine against human and avian influenza A viruses: its effects on hemagglutination and sialidase activities. Virol J 2009;6:124.
- Bigliardi PL, Alsagoff SAL, El-Kafrawi HY, et al. Povidone iodine in wound healing: a review of current concepts and practices. Int J Surg 2017;44:260–8.
- Eggers M. Infectious disease management and control with povidone iodine. Infect Dis Ther 2019;8:581–93.
- Schreier H, Erdos G, Reimer K, et al. Molecular effects of povidone-iodine on relevant microorganisms: an electron-microscopic and biochemical study. Dermatology 1997;195(Suppl 2):111–6.
- Barry P, Cordoves L, Susanne G. ESCRS Guidelines for Prevention and Treatment of Endophthalmitis Following Cataract Surgery: Data Dilemmas and Conclusions 2013 [Internet] 2013; Available from: http://escrs.org/endophthalmitis/guidelines/ENGLISH.pdf.
- Wykoff CC, Parrott MB, Flynn HW Jr, et al. Nosocomial acute-onset postoperative endophthalmitis at a university teaching hospital. Am J Ophthalmol 2010; 150:392–8e2.
- Shimada H, Nakashizuka H, Hattori T, et al. Effect of operative field irrigation on intraoperative bacterial contamination and postoperative endophthalmitis rates in 25-gauge vitrectomy. Retina 2010; 30:1242–1249.
- Zhu Y, Chen X, Chen P, et al. The occurrence rate of acute-onset postoperative endophthalmitis after cataract surgery in Chinese small- and medium- scale departments of ophthalmology. Sci Rep 2017; 7:40776.
- Berkelman RL, Holland BW, Anderson RL. Increased bactericidal activity of dilute preparations of povidone-iodine solutions. J Clin Microbiol 1982; 15:635–639.
- Hosseini H, Ashraf MJ, Saleh M, et al. Effect of povidone-iodine concentration and exposure time on bacteria isolated from endophthalmitis cases. J Cataract Refract Surg 2012; 38:92–96.
- SilasMR, Schroeder RM, Thomson RB, Myers WG. Optimizing the antisepsis protocol: effectiveness of 3 povidone-iodine 1.0% applications versus a single application
- Koerner,J.C.;George,M.J.;Meyer,D.R.;Rosco,M.G.;Habib,M.M.Povidone iodine concentration and dosing in cataract surgery.Ophthalmol. 2018,63,862–868.
- Reibaldi, M.; Avitabile, T.; Bandello, F.; Longo, A.; Bonfiglio, V.; Russo, A.; et al.. The Effectiveness of 0.6% Povidone Iodine Eye Drops in Reducing the Conjunctival Bacterial Load and Needle Contamination in Patients Undergoing Anti-VEGF Intravitreal Injection: A Prospective, Randomized Study. Clin. Med.2019, 8, 1031
- Musumeci,R.;Bandello,F.;Martinelli,M.;Calaresu,E.;Cocuzza,C.E. In vitro bactericidal activity of 0.6% povidone-iodine eye drops formulation.J.Ophthalmol.2018,7,1120672118802541.
- Pinna,A.;Donadu,M.G.;Usai,D.;D’amicoRicci,G.;Boscia,F.;Zanetti,S. In Vitro antimicrobial activity of a new ophthalmic solution containing povidone-iodine 0.6% (IODIM®).2018,96,111.
- Friedman DA, Mason JO 3rd, Emond T, McGwin G Jr. Povidone-iodine contact time and lid speculum use during intravitreal injection. Retina 2013; 33:975–981.
- Nakashizuka,H.;Shoji,J.;Shimada,H.;Yuzawa,M.Experimental Visualization and Quantification of Vitreous Contamination Following Intravitreal Injections.Retina2016,36,1882–1887.
- Jiang J, Wu M, Shen T. The toxic effect of different concentrations of povidone iodine on the rabbit’s cornea. Cutan Ocul Toxicol 2009; 28:119–124.
- ElKitkat RS, Ebeid WM, Habib EK, Shoukry Y. Safety of intracameral injection of minimal bactericidal concentration of povidone iodine on the corneal endothelium in a rabbit model. Cornea 2016; 35:72–76.
- Jiang J, Wu M, Shen T. The toxic effect of different concentrations of povidone iodine on the rabbit’s cornea. Cutan Ocul Toxicol 2009; 28:119–124.
- Chabrolle JP, Rossier A. Goitre and hypothyroidism in the newborn after cutaneous absorption of iodine. Arch Dis Child 1978; 53:495–498.
- Oakley CL, Vote BJ. Aqueous chlorhexidine is an effective alternative to povidone-iodine for intravitreal injection prophylaxis. Acta Ophthalmol[Internet] 2017 [Epub ahead of print]; Available from: http://dx.doi.org/10.1111/aos.13340.
- Hsu HY, Lind JT, Tseng L, Miller D. Ocular flora and their antibiotic resistance patterns in the midwest: a prospective study of patients undergoing cataract surgery. Am J Ophthalmol 2013; 155:36–44e2.
- Grzybowski A, Brona P, Kim SJ. Microbial flora and resistance in ophthalmology: a review. Graefes Arch Clin Exp Ophthalmol 2017; 255:851–862.
- Kim SJ, Toma HS. Antimicrobial resistance and ophthalmic antibiotics: 1-year results of a longitudinal controlled study of patients undergoing intravitreal injections. Arch Ophthalmol 2011; 129:1180–1188.
- Hsu J, Gerstenblith AT, Garg SJ, Vander JF. Conjunctival flora antibiotic resistance patterns after serial intravitreal injections without postinjection topical antibiotics. Am J Ophthalmol 2014; 157:514–580.
- Mazoteras P, Quiles MG, Martins Bispo PJ, et al. Analysis of intraocular lens biofilms and fluids after long-term uncomplicated cataract surgery. Am J Ophthalmol 2016; 169:46–57.
- Speaker MG, Menikoff JA. Prophylaxis of endophthalmitis with topical povidone- iodine. Ophthalmology 1991; 98:1769–1775.
- Schwartz SG, Flynn HW Jr, Grzybowski A, et al. Intracameral antibiotics and cataract surgery: endophthalmitis rates, costs, and stewardship. Ophthalmology 2016; 123:1411–1413.
- Wu P-C, Li M, Chang S-J, et al. Risk of endophthalmitis after cataract surgery using different protocols for povidone- iodine preoperative disinfection. JOcul Pharmacol Ther 2006; 22:54–61.
- Halachmi-Eyal O, Halachimi-Eyal O, Lang Y, et al. Preoperative topical moxifloxacin 0.5% and povidone-iodine 5. 0% versus povidone-iodine 5 0% alone to reduce bacterial colonization in the conjunctival sac J Cataract Refract Surg 2009; 35:2109–2114.
- Eslami, Jamshid Ph.D; Rezaei, Roghayeh M.Sc; Jamali, Hossein M.D; Sedaghat, Ahad M.D; Nowroozzadeh, M. Hossein M.D Effect of topical povidone-iodine 10% plus levofloxacin 0.5% one hour before cataract surgery in eliminating perioperative conjunctival flora, Journal of Cataract & Refractive Surgery: September 16, 2020
- Grzybowski A. The role of antibiotics in the prevention of postintravitreal anti- VEGF endophthalmitis: primum non nocere! Eye. Eye (Lond) 2014; 28:500.
- Schwartz SG, Flynn HW, Grzybowski A. Controversies in topical antibiotics use with intravitreal injections. Curr Pharm Des 2015; 21:4703–4706.
- Modjtahedi BS, van Zyl T, Pandya HK, et al. Endophthalmitis after intravitreal injections in patients with self-reported iodine allergy. Am J Ophthalmol 2016; 170:68–74.
- Cheung CSY, Wong AWT, Lui A, et al. Incidence of endophthalmitis and use of antibiotic prophylaxis after intravitreal injections. Ophthalmology 2012; 119:1609–1614.
- Shimada H, Nakashizuka H, Hattori T, et al. Prophylaxis for acute scleral buckle infection using 0.25% povidone-iodine ocular surface irrigation during surgery. Int Ophthalmol 2014; 34:211–216.
- Lindquist TD, Maxwell AJ, Miller TD, et al. Preparation of corneal donor eyes comparing 1% versus 5% povidone-iodine. Cornea 2011; 30: 333–337.
- Nishida H, Risemberg HM. Silver nitrate ophthalmic solution and chemical conjunctivities. Pediatrics 1975; 56:368–373.
- Isenberg SJ, Apt L, Yoshimori R, et al. Povidone-iodine for ophthalmia neonatorum prophylaxis. Am J Ophthalmol 1994; 118:701–706.
- Isenberg SJ, Apt L, Wood M. A controlled trial of povidone-iodine as prophylaxis against ophthalmia neonatorum. N Engl J Med 1995; 332:562–566.
- Khan FA, Hussain MA, Khan Niazi SP, et al. Efficacy of 2.5% and 1.25% povidone-iodine solution for prophylaxis of ophthalmia neonatorum. J Coll Physicians Surg Pak 2016; 26:121–124.
- Isenberg SJ, Apt L, Valenton M, et al. Prospective, randomized clinical trial of povidone-iodine 1.25% solution versus topical antibiotics for treatment of bacterial keratitis. Am J Ophthalmol [Internet] 2016; 176:244–253; Available from: http://dx.doi.org/10.1016/j.ajo.2016.10.004.
- Sauerbrei A, Sehr K, Eichhorn U, et al. Inactivation of human adenovirus genome by different groups of disinfectants. J Hosp Infect 2004;57:67–72.
- Sauerbrei A, Eichhorn U, Scheibenzuber M, et al. Hexon denaturation of human adenoviruses by different groups of biocides. J Hosp Infect 2007;65:264–70.
- Shorter E, Whiteside M, Harthan J, et al. Safety and tolerability of a one-time, in-office administration of 5% povidone-iodine in the treatment of adenoviral conjunctivitis: The Reducing Adenoviral Patient Infected Days (RAPID) study. Ocul Surf 2019;17:828–32.
- Trinavarat A, Atchaneeyasakul L-O. Treatment of epidemic keratoconjunctivitis with 2% povidone-iodine: a pilot study. J Ocul Pharmacol Ther 2012;28:53–8.
- Yazar H, Yarbag A, Balci M, et al. The effects of povidone iodine (pH 4.2) on patients with adenoviral conjunctivitis. J Pak Med Assoc 2016;66:968–70.
- Özen Tunay Z, Ozdemir O, Petricli IS. Povidone iodine in the treatment of adenoviral conjunctivitis in infants. Cutan Ocul Toxicol 2015;34:12–15.
- Pepose JS, Narvekar A, Liu W, et al. A randomized controlled trial of povidone-iodine/ dexamethasone ophthalmic suspension for acute viral conjunctivitis. Clin Ophthalmol 2019;13:535–44.
AUTORES

Rahul Rachwani Anil
– Hospital Regional Universitario de Málaga
Carlos Rocha de Lossada
– Hospital Universitario Virgen de las Nieves. Granada
1 Comentarios
esteban medina
febrero 28, 2021MUCHAS GRACIAS POR COMPARTIR TAN IMPORTANTE INFORMACION , FELICITACIONES !!!! Y GRACIAS NUEVAMENTEAL DR SOLER