CASO
El Dr. Rodrigo González nos presenta el caso de una mujer de 68 años operada 6 años antes en otro centro de facoemulsificación e implante de lente intraocular (LIO) en ambos ojos.
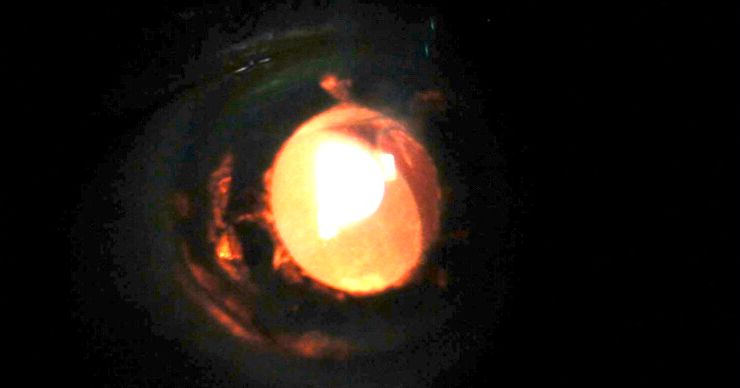
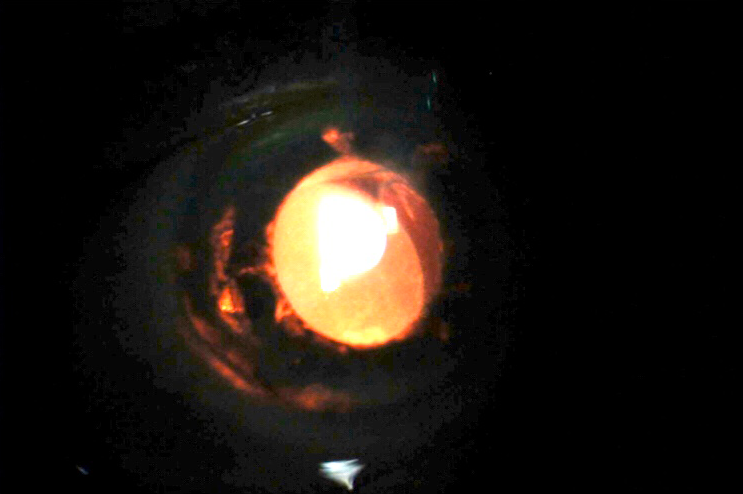
A la exploración presenta una agudeza visual de 20/40 y 20/30 en ambos ojos y una presión intraocular (PIO) de 46mmHg y 14mmHg respectivamente. Biomicroscópicamente se apreciaba, en el ojo derecho, abundante pigmento incisional y atrofia iridiana sectorial temporal en relación con la subluxación de un háptico de la LIO a sulcus.
En la tomografía de coherencia óptica (OCT) del segmento anterior no se apreciaba ningún daño estructural y a nivel angular presentaba acúmulo de pigmento en malla trabecular.
En ese momento el Dr. Rodrigo González inició tratamiento hipotensor con timolol y dorzolamida tópicos bajando la PIO hasta 28 y a continuación añadió travoprost disminuyendo la PIO hasta 14 mmHg.
OPCIONES TERAPÉUTICAS PROPUESTAS
- Reposicionamiento de la LIO en saco. Solución propuesta por Dr. Rodrigo González.
- Extracción y recambio de LIO. Solución propuesta por Dr. Randall Ulate, Dr. Luis W. Lu y Dr. Xavier Campos
- Amputación de háptico luxado. Solución propuesta por Dr. Jorge buonsanti
- Observación y control de PIO mediante hipotensores tópicos y/o SLT. Solución propuesta por Dr. Christian Fau y Dr. José Bulacio)
INTRODUCCIÓN
El síndrome de uveítis-glaucoma-hifema (UGH), también conocido como síndrome de Ellingson, fue descrito por primera vez el año 1977 por el Dr. Ellingson el cuál describió este síndrome en asociación a un excesivo movimiento de la LIO a causa de un tamaño reducido o una luxación de la misma. Asimismo, errores de producción en los bordes ópticos, LIOs de anclaje iridiano y LIOs de hápticos rígidos (“closed looped rigid”) fueron asociados al síndrome de UGH.1
El síndrome de UGH consiste en una infrecuente asociación de transiluminación iridiana, dispersión pigmentaria, hifemas/microhifemas y elevación de la PIO causado por el traumatismo mecánico de la LIO con el epitelio pigmentario iridiano, el cuerpo ciliar y las estructuras del ángulo iridocorneal. El síndrome UGH también puede asociar inflamación crónica, rubeosis iridiana y edema macular quístico.2
La incidencia ha disminuido con la mejoría en la producción de las LIOs y se reduce drásticamente el riesgo especialmente si estas son implantadas correctamente en el saco capsular pasando de un 2,2-3% a menos de un 1% en la actualidad.3
Estudios epidemiológicos han demostrado una mayor incidencia de UGH en lentes de cámara anterior (CA) y en aquellas de fijación iridiana, aunque también se han descrito casos asociados a lentes de cámara posterior (CP). Es el caso de un estudio retrospectivo de Gainesville llevado a término en la Universidad de Florida, donde fueron analizados 97 casos de UGH. De ellos, el 54% asociaron una LIO de CA, el 34% LIO de fijación iridiana y el 12% restante LIOs de CP.4 Chan et al estudiaron la incidencia de UGH en paciente con implantación de LIO en sulcus en función del tipo de lente implantada. Los resultados mostraron una incidencia del 7,1% en aquellos pacientes con una LIO de 3 piezas mientras que todos los pacientes con una LIO acrílica monobloque acabaron presentando UGH.5
También ha sido descrito una relación entre las LIOs con borde afilado y el síndrome UGH.6
FISIOPATOLOGÍA
El origen fisiopatológico del síndrome de UGH reside en el traumatismo mecánico crónico generado por la LIO contra el iris, cuerpo ciliar o estructuras del angulo iridocorneal que acaba generando una ruptura de la barrera hemato-acuosa. Este roce con el tejido vascular uveal es el responsable de los sangrados, la dispersión pigmentaria y la inflamación dando lugar a hifemas, uveítis anteriores de repetición y elevación de la PIO.1
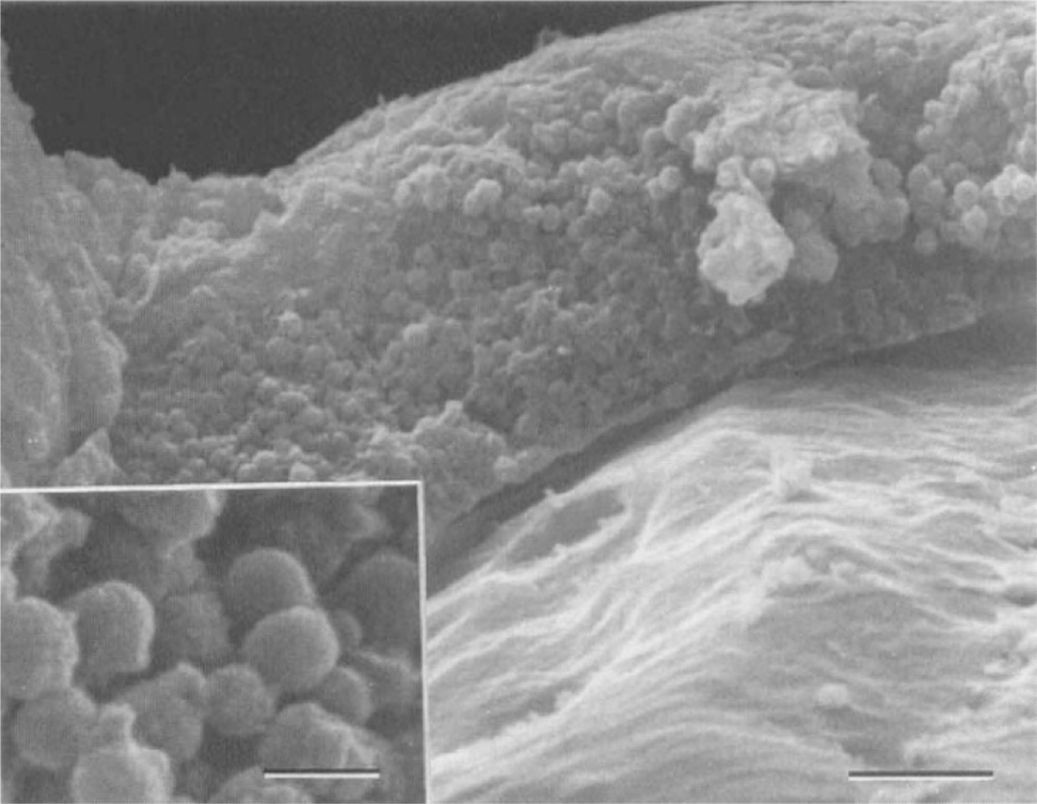
Mediante el estudio con microscopía electrónica de las LIOs extraídas de pacientes con síndrome de UGH se pudieron observar depósitos de material cocoide en los hápticos (Fig 2). Estos serían melanosomas derivados del daño del epitelio pigmentario iridiano.7
La elevación de la PIO tiene un origen multifactorial; el proceso inflamatorio crónico, el depósito pigmentario en malla trabecular y el bloqueo de la malla trabecular por macrófagos con residuos de células hemáticas. Ello puede llevar a un daño del nervio óptico y el desarrollo de glaucoma8.
MANIFESTACIÓN CLÍNICA
La forma de presentación más común del síndrome de UGH consiste en la disminución de AV meses después de la cirugía de facoemulsificación e implante de la LIO. Además, los pacientes pueden presentar dolor, fotofobia, hiperemia y uveítis anterior con aumento de la PIO. A la exploración biomicroscópica podremos encontrar células hemáticas en CA (con o sin hifema asociado), neovascularización iridiana y edema corneal si la LIO está parcialmente en contacto con el endotelio corneal.9
Otras formas de presentación serán los denominados UGH Plus, asociando hemovítreo, y el UGH incompleto posterior donde encontraremos sangrado en CP en ausencia de inflamación.
DIAGNÓSTICO
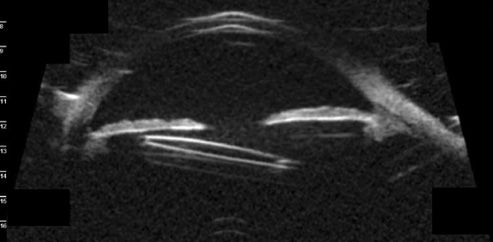
La anamnesis completa y la exploración biomicroscópica serán las primeras herramientas ante la sospecha del diagnóstico del síndrome UGH. Aun así, y para la confirmación de la posición de la LIO será útil la ampliación del estudio con tomografía de coherencia óptica (OCT) y la ultrasonografía biomicroscópica (UBM) como recome daron los Dres. Luis W. Lu y Luis León.10
Múltiples estudios remarcan la importancia de la exploración mediante UBM, como método de confirmación, para completar el estudio y precisar ubicación exacta de la LIO y sus hápticos. Esto nos ayudará también a determinar el manejo de nuestro paciente.11,12
TRATAMIENTO
El tratamiento tópico con corticoesteroides e hipotensores pueden ayudar a controlar la inflamación y la tensión intraocular a corto-medio plazo. En este caso es conveniente evitar los parasimpaticomiméticos por sus posibles efectos mióticos y el aumento del roce iridiano con la LIO.13 En caso de presencia de hifema será aconsejable el reposo relativo, el descanso con la cabeza en elevada y el uso de colirios ciclopléjicos.14
La indicación del tratamiento quirúrgico definitivo va a depender de la agudeza visual, la PIO, la inflamación intraocular y la respuesta al tratamiento tópico.6
En caso de precisar revisión quirúrgica su abordaje dependerá principalmente del tipo de lente y la localización de ésta. Si nos encontramos ante una lente monobloque situada en sulcus la principal indicación será el recambio por una lente de 3 piezas. De esta manera, la lente reducirá el roce iridiano debido al menor tamaño de los hápticos y poseer un borde redondeado así como la angulación de los hápticos. Asimismo, cuando nos encontramos con una lente situada en saco capsular y una luxación de un háptico, independientemente del tipo de lente que nos encontremos, el manejo va a depender principalmente del tiempo de evolución respecto a la cirugía de facoemulsificación y del estado del saco capsular.15 Cuando el hallazgo es visualizado en el postoperatorio inmediato, la mejor opción consistirá en reposicionar el háptico luxado en el saco, siempre con la ayuda de un viscoelástico para facilitar la completa abertura y minimizar el trauma al saco capsular. Sin embargo, si nos encontramos con un UGH tiempo después de la cirugía lo más habitual será encontrar la fusión entre cápsula anterior y posterior sacular. En estos casos la recolocación puede suponer un riesgo elevado de rotura capsular y la principal alternativa consistiría en el recambio de lente por una de 3 piezas situada en sulcus y con captura de la óptica mediante la cápsula anterior o doble captura (también con la cápsula posterior) si éstas se encuentran fusionadas.16 No obstante, publicaciones recientes añaden la opción de amputar el háptico luxado, como comentaba el Dr. Jorge Buonsanti, mostrando muy buenos resultados ópticos por el paciente15.
Finalmente, y como terapia alternativa, en pacientes con de neovascularización iridiana se ha estudiado la inyección de Bevacizumab (2,5mg) intravítreo y en cámara anterior demostrando buenos resultados con regresión vascular y buena tolerancia a nivel endotelial. No obstante, se han observado elevaciones transitorias de la PIO, que podrían ser resueltas con una paracentesis. Sería conveniente ampliar los estudios para estudiar la posible pérdida de células endoteliales tras inyecciones repetidas de Bevacizumab en cámara anterior.17
CONCLUSIONES
El síndrome UGH es una entidad clínica cuya incidencia se ha visto reducida con la mejoría de las técnicas quirúrgicas y la mejoría de las LIOs y por lo tanto será importante un alto índice de sospecha para su diagnóstico.
La presentación más frecuente es la asociada a brotes de inflamación en el segmento anterior junto a la elevación de la PIO que a menudo se acompañarán de hifema/microhifiema, lo que podría causar una disminución en la agudeza visual de los pacientes y a largo plazo dañar el nervio óptico.
Asimismo, será importante el tratamiento enérgico de los pacientes cuyo tratamiento definitivo consistirá en la intervención quirúrgica para eliminar el factor que genere el roce de la LIO con el epitelio pigmentario iridiano o el cuerpo ciliar.
BIBLIOGRAFÍA
- Mihail Z, Georgiana C. Uveitis – Glaucoma – Hyphaema Syndrome . General review. 2017;61(1):11–7.
- Foroozan R. Tabas JG, Moster ML. Recurrent microhyphaema despite intracapsular fixation of a posterior chamber intraocular lens. J Cataract Refract Surg. 2003; 29:1632-5
- Apple DJ, Mamlis N, Loftfield K, Googe JM, Novak LC, Kavka-van Norman D, Brady SE, Olson RJ. Complications of Intraocular Lenses. A Historical and Histopathological Review. Surv Ophthalmol. 1984; 29:1-54.
- Hanh M, Nguyen T. Uveitis-Glaucoma-Hyphaema syndrome. New England Medical Center Grand Rounds, Tufts University.
- Chan TC, Lok JK, Jhanji V, Wong VW. Intraocular lens explantation in Chinese patients: different patterns and different responses. Int 2015 Oct; 35(5):679-84. doi: 10.1007/s10792-014-9996-7.
- Yang J, Qiu X, Cai L, Fan Q, Wang A, Zhang K, et al. Uveitis-glaucoma-hyphema syndrome associated with an in-the-bag square-edge intraocular lens. Precis Clin Med. 2019;2(4):283–7.
- Asaria RH, Salmon JF, Skinner AR, et al. Electron micros-copy findings on an intraocular lens in the uveitis, glaucoma, hyphaema syndrome. Eye 1997;11:827–829.
- Asaria RH, Salmon JF, Skinner AR, Ferguson DJ, McDonald B. Electron microscopy findings on an intraocular lens in the uveitis, glaucoma, hyphaema syndrome. Eye. 1997; 11(Pt 6):827-9.
- Cates CA, Newman DK. Transient monocular visual loss due to uveitis-glaucoma-hyphaema (UGH) syndrome. J Neurol Neurosurg Psychiatry. 1998; 65:131–132.
- Alfaro-Juárez A, Vital-Berral C, Sánchez-Vicente JL, Alfaro-Juárez A, Muñoz-Morales A. Uveitis-glaucoma- hyphaema syndrome associated with recurrent vitreous hemorrhage. Arch Soc Esp Oftalmol. 2015; 90:392-4. doi: 10.1016/j.oftale.2015.08.007.
- Piette, S., Canlas, O. A. Q., Tran, H. V., Ishikawa, H., Liebmann, J. M., & Ritch, R. (2002). Ultrasound biomicroscopy in uveitis-glaucoma- hyphema syndrome. American Journal of Ophthalmology, 133(6), 839–841.
- Pavlin CJ, Harasiewicz K, Foster FS. Ultrasound biomicroscopic analysis of haptic position in late-onset, recurrent hyphema after posterior chamber lens implantation. J Cata- ract Refract Surg 1994;20:182–185
- Bodh SA, Kumar V, Raina UK, Ghosh B, Thakar M. Inflammatory glaucoma. Oman J Ophthalmol. 2011 Jan- Apr; 4(1):3–9.
- Crowell EL. Uveitis-Glaucoma-Hyphaema Syndrome. http://eyewiki.aao.org.
- El Wardani M, Kymionis G, Salmon B, Hashemi K, Wolfensberger TJ. Uveitis-Glaucoma-Hyphema Syndrome Treated with Haptic Amputation. Klin Monbl Augenheilkd. 2019;236(4):581–3.
- Campos X, Ahmed IK, Shah M. IOL Exchange and Double Optic Capture for the Man- agement of Uveitis-Glaucoma-Hyphema Syndrome. Eyetube; 2015.
- Rech L, Heckler L, Damji KF. Serial intracameral bevacizumab for syndrome: a case report. Can J Ophthalmol. 2014; 49:e160–e162.
Autores

Xavier Carreras Castañer
– Residente de 2º año del Hospital Clinic de Barcelona

Carlos Rocha de Lossada
– Fellowship en Córnea y Segmento Anterior del Hospital Clinic de Barcelona