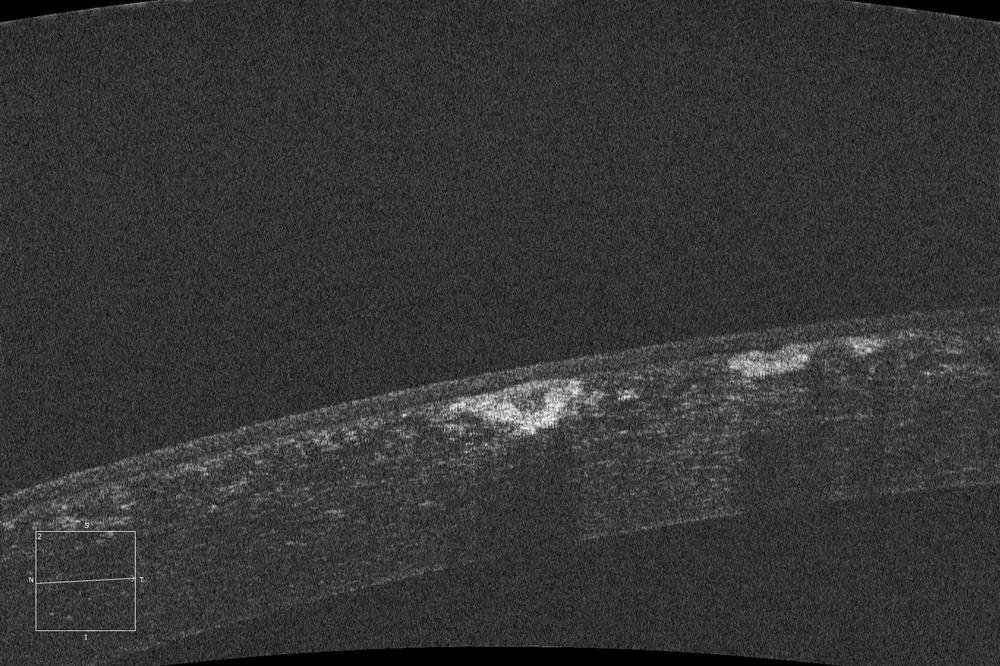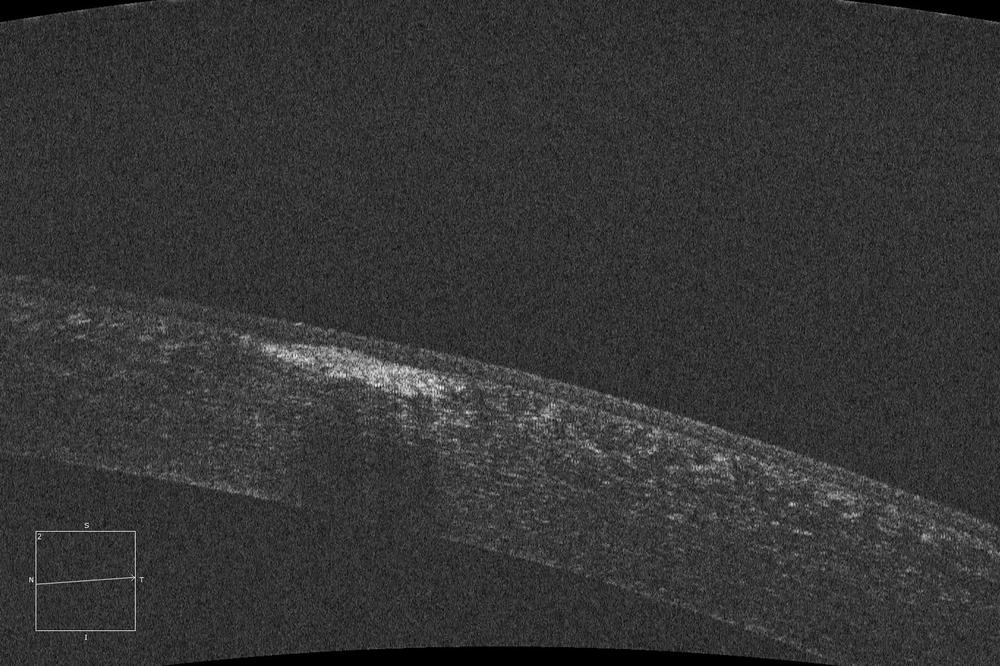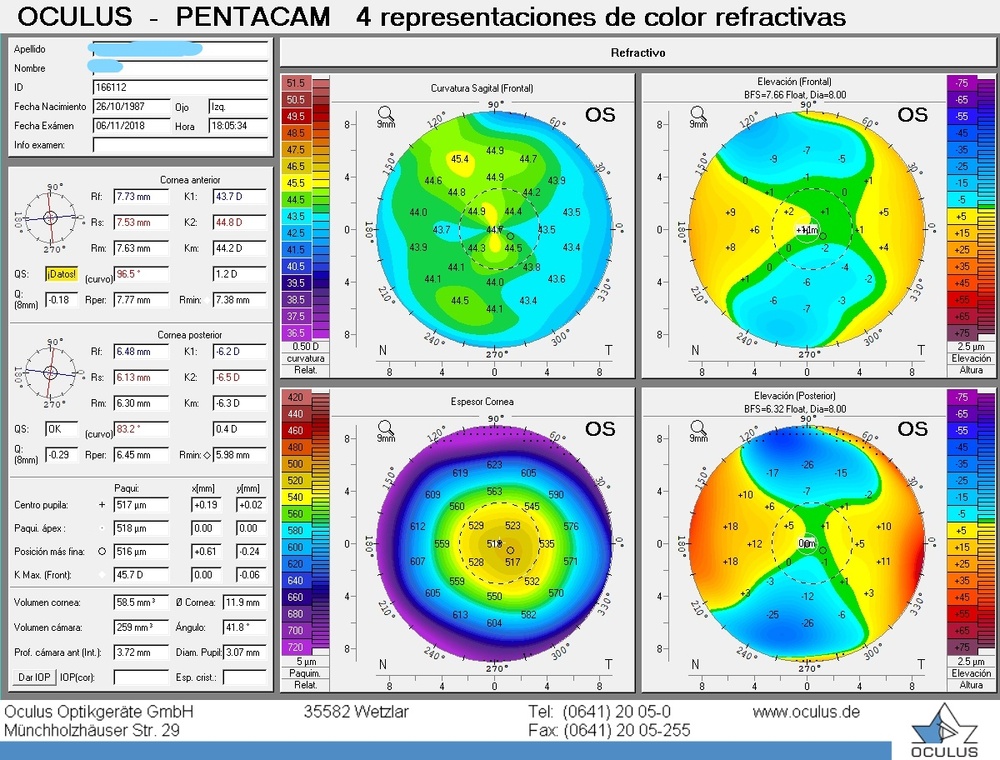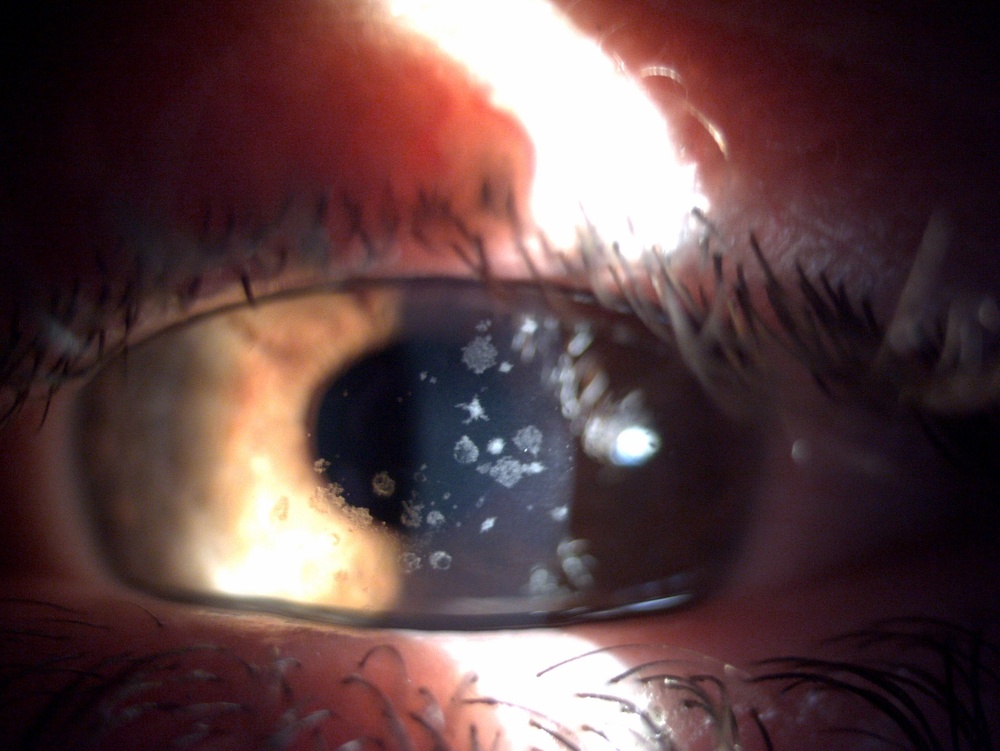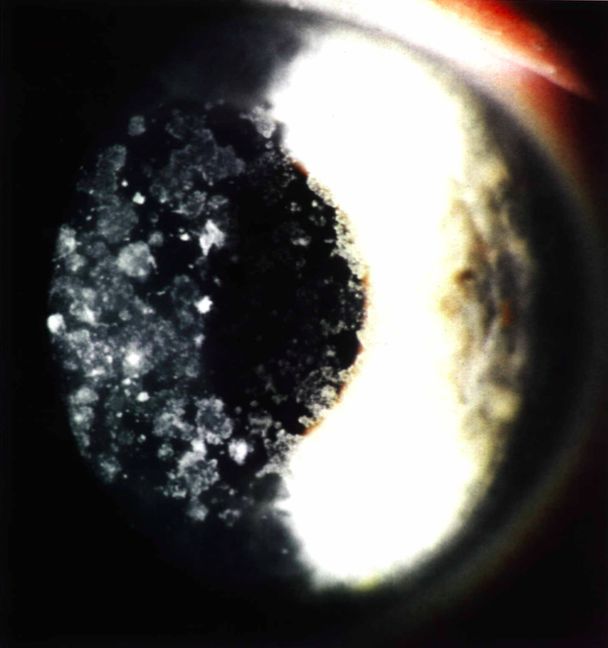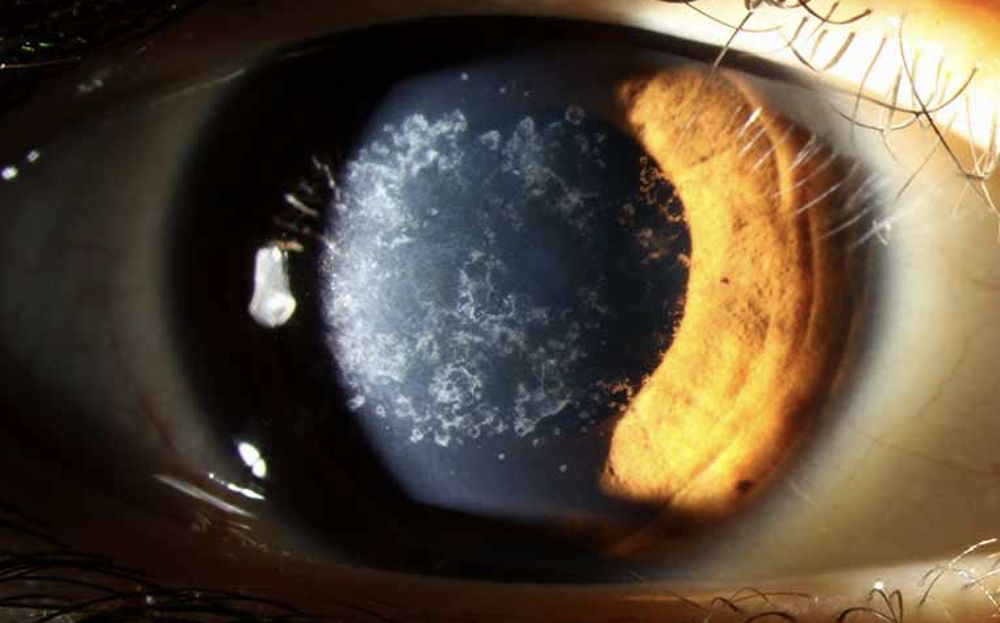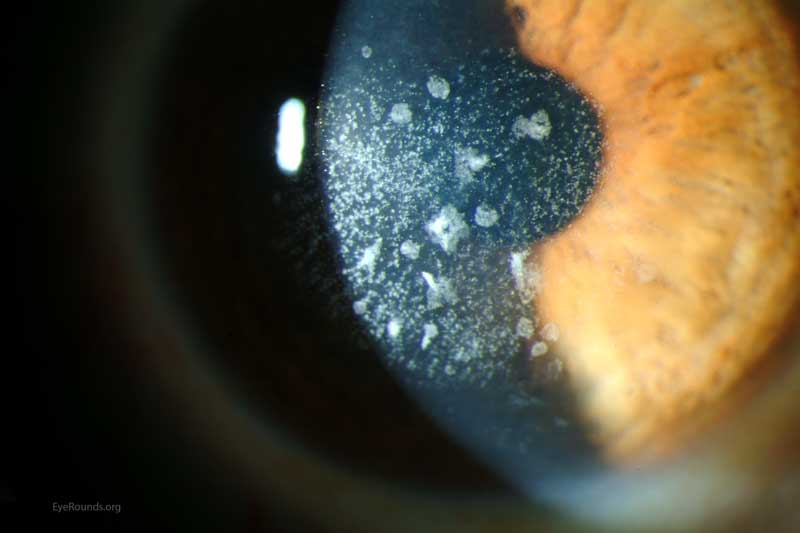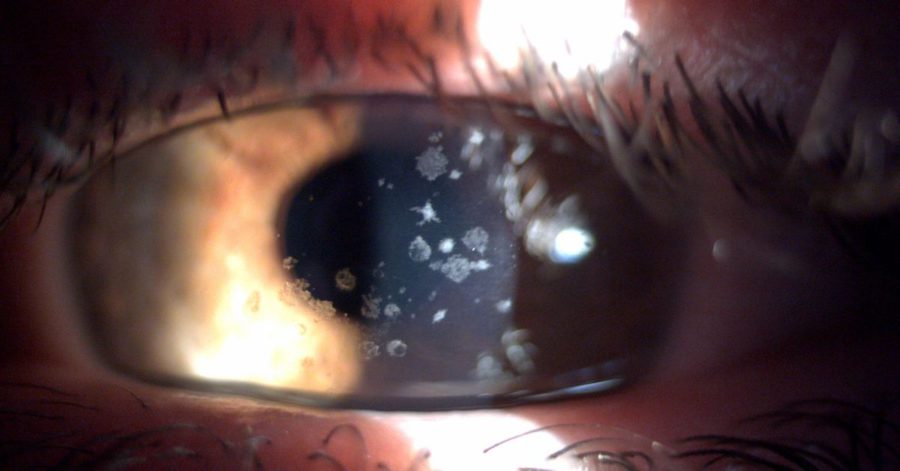
El pasado mes de Junio el Dr. Durán De La Colina preguntó al foro a través del hilo “Lasik en Groenouw” las distintas posibilidades terapéuticas-refractivas en un paciente varón de 31 años con una distrofia de Groenouw, amétrope de -1.50 x 90º en OD y -2.00 -1.50 x 180º en OI. La AV espontánea en OD era de 0.6 y la AVMC en OI de 1.0.
INTRODUCCIÓN
Las distrofias corneales son un grupo de enfermedades hereditarias, bilaterales, simétricas, lentamente progresivas y generalmente no tienen relación con factores ambientales o sistémicos(1).
Se clasifican anatómicamente, según la capa corneal afectada, en distrofias epiteliales, subepiteliales, de la membrana de Bowman, estromales, de la membrana de Descemet y endoteliales. Entre las distrofias corneales anteriores se encuentras las siguientes distrofias: corneal de membrana basal, Meesmann, epitelial de Lisch, Reis-Bücklers y Thiel-Behnke. Las distrofias estromales incluyen la granular, Lattice, Avellino, macular, Schnyder, fleck y la central nubosa de François. Las distrofias posteriores más comunes son la de Fuchs y la polimorfa posterior(1).
Las distrofias corneales son infrecuentes, con una prevalencia aproximada de 0.09% en EE. UU(2). Sin embargo, los errores refractivos son comunes y pueden forzar a los pacientes que lo padecen a solicitar opciones terapéuticas-refractivas. Algunas distrofias pueden empeorar tras queratomileusis in situ asistida con láser (LASIK) y pueden generar algunas complicaciones que posteriormente detallaremos.
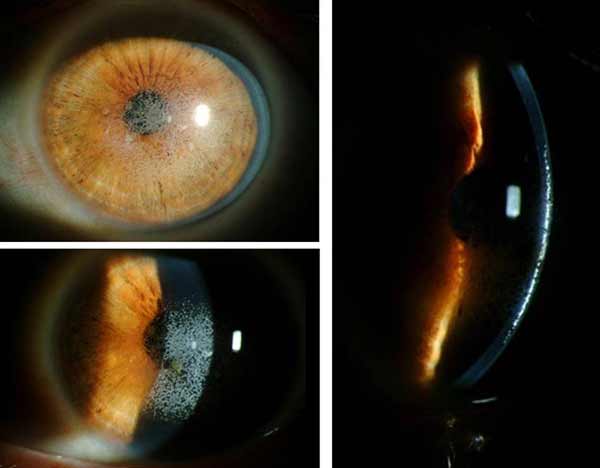
La queratectomía fotorrefractiva (PRK) puede evitar alguna de estas complicaciones y puede suponer una mejor opción para la corrección de la ametropía en ojos con distrofias corneales, aunque la PRK también ha sido asociada con la exacerbación de algunas distrofias estromales(3).
La queratectomía fototerapéutica (PTK), también utilizada en el tratamiento de las distrofias corneales, utiliza un láser excímer de 193-nm. La PTK fue aprobada por la FDA en 1995 para el tratamiento de las distrofias corneales anteriores. Las guías de la FDA especifican que no se puede ablacionar más de un tercio del espesor corneal, y que al menos 250mm de estroma debe permanecer tras la cirugía(3). De este modo, un procedimiento PTK suele involucrar ablaciones estromales entre 40 y 100mm. Los pacientes candidatos para PTK son aquellos con distrofias que afectan el 10-20% de la córnea anterior(3, 5). Entre las ventajas principales de la PTK destacan que es mínimamente invasivo, repetible, permite un control preciso del área de ablación, una base suave para la re-epitelización corneal, y puede prevenir o retrasar la necesidad de procedimientos invasivos tales como la queratoplastia lamelar o penetrante. Las desventajas principales son la inducción de un efecto hipermetrópico, haze estromal y molestias postoperatorias(3).
OPCIONES PLANTEADAS EN EL FORO
- Queratectomía Fotorrefractiva Transepitelial (TransPRK) con un equipo SCHWIND AMARIS
Dr. Fau, Dr. Sterzovsky, Dr. Pacheco
A diferencia de la PRK, la técnica TransPRK (T-PRK) consiste en eliminar el epitelio mediante láser, siendo una técnica no-touch. Inicialmente, esta técnica consistía en un procedimiento de dos pasos, una PTK seguida de PRK. Actualmente, existe la T-PRK en un solo paso, de manera que se realiza la ablación en una sesión única y continua, siendo de menor duración que la PRK convencional y la T-PRK de dos pasos. La T-PRK incorpora un normograma de grosor epitelial basado en un modelo poblacional. El algoritmo del láser, basado en una base de datos poblacional, calcula una ablación epitelial de 55µm de profundidad central y 65µm en la periferia. El principal inconveniente de la T-PRK es el efecto refractivo impredecible en casos de epitelio no homogéneo.
El Dr. Fau recomienda realizar esta técnica añadiendo MMC durante 30 segundos, sumado a un programa libre de aberraciones inducidas.
El Dr. Pacheco también recomienda realizar una T-PRK con equipo Schwind debido a que este realiza ablaciones profundas, previa medición exacta de la profundidad de las opacidades. No obstante, cuestiona el uso de la MMC puesto que la refracción es baja,
El Dr. Sterzovsy compartió su experiencia mediante esta cirugía en 4 pacientes bilaterales con distrofia de Groenouw, 2 con hipermetropía y 2 con miopía. Todos fueron intervenidos mediante transPRK con equipos Schwind y Allegretto más MMC 0,02% durante 30 segundos. En los 8 ojos, en tiempos variables, las opacidades recurrieron. Refractivamente, todos mostraron excelentes resultados iniciales y aceptables tras la recurrencia. Como conclusión, el Dr. Sterzovsky sugiere que esta técnica se puede llevar a cabo para este caso prediciendo buenos resultados refractivos, aunque advirtiendo al paciente que hay grandes posibilidades de recurrencia de las opacidades.
- PRK
Dr. Palomino, Dr. Cremona, Dr. Ortega, Dr. Ramírez, Dr. Galue
El Dr. Palomino y el Dr. Cremona sugieren realizar una PRK dada a la impresión de escasa profundidad de las lesiones y el poco componente miópico del paciente.
El Dr. Ortega se suma a esta opción. Además, sugiere realizar únicamente una aberrometría optimizada sobre la corrección esférica y cilíndrica, ya que la aberrometría corneal sería caótica dada las opacidades. El Dr. Ramírez opina lo mismo en cuanto a la aberración, ya que el remoldeamiento epitelial aumentaría el espesor corneal hasta el 20% en un año.
El Dr. Galue sostiene que llevaría a cabo una PRK + MMC 30 segundos puesto que la distrofia progresará, bien se haga un tratamiento fotorrefractivo o no. Aunque no todas las lesiones se eliminarían por completo, se atenuarían muchas de ellas, y el paciente quedaría refractivamente satisfecho.
- Enfoque como cirugía fototerapéutica:
Dr. Cazal, Dr. Suárez
El Dr. Cazal sugiere enfocar este caso como un caso de cirugía corneal fototerapéutica (PTK), advirtiendo al paciente la falta de previsibilidad y pronóstico con respecto a la recurrencia de las opacidades. Además, llevaría a cabo un despistaje genético de mutaciones TGFBI para descartar cirugía refractiva en dichos pacientes, dada la dificultad y la inexactitud del diagnóstico de las distrofias corneales mediante historia clínica y examen de lámpara hendidura. Se postula que este despistaje genético debería estar incorporada en la práctica habitual(6).
El Dr. Suárez también sugiere que, al no ser una córnea sana y al tratarse de una condición progresiva, el paciente no sería candidato a tratamiento fotorrefractivo.
Fuente: J.Steinberg and S.J. Lienke. Complications in Corneal Laser Surgery - LIO Fáquica
Dr. Rodríguez, Dr. Suárez, Dr. Navarro
Debido a que cualquier procedimiento corneal puede exacerbar estas lesiones, y ya que el paciente es joven y ve la unidad, el Dr. Rodríguez y el Dr. Navarro sugieren que el paciente sería buen candidato, con una ACD de 3.72mm, a una LIO fáquica.
El Dr. Rodríguez sugería que «Algunas de las opacidades superan las 150 micras de profundidad, y dado que la paquimetría medida en Pentacam es de aproximadamente 500 micras es probable que no se eliminen todas las lesiones. De lo contrario, obtendríamos un estroma residual muy bajo con el consiguiente riesgo de ectasia posterior.»
El paciente del que discutimos fue tratado mediante PRK hipermetrópico +2.00 y PTK de 80 µm de ablación en la misma sesión. El objetivo planteado fue tratar el defecto refractivo, así como eliminar las opacidades en el mismo tiempo.
El resultado al mes resultó en una AV espontánea de 0.1 debido a una sorpresa refractiva de +6.50 -1.50 x 75º, que mejoraba a 0.5 con corrección. Bien es cierto que las opacidades disminuyeron, liberando en gran parte el eje pupilar central. Sin embargo, el resultado refractivo sugiere que el aplanamiento central por la PTK sumado a la ablación anular periférica hipermetrópica de la PRK hayan podido resultar en esta sorpresa refractiva, tal como apunta el Dr. Ramírez.
Con el consenso de esperar 6 meses para ver la evolución tras el remoldeamiento epitelial, las opciones que plantea el foro son realizar una nueva PRK o realizar una lensectomía refractiva.
DISTROFIA GRANULAR TIPO 1 (GROENOW TIPO 1)
La distrofia estromal granular, junto con las distrofias estromales reticular y de Avellino, es una distrofia corneal con herencia AD que surge debido a mutaciones en el gen inductor del factor de crecimiento transformador beta (TGFBI) localizado en el cromosoma 5q31. Este gen codifica la proteína queratoepitelina, que es secretado por el epitelio corneal. La mutación de proteínas queratoepitelinas pasan a través de la membrana de Bowman y el estroma, dónde se agregan para formar depósitos insolubles. Las distrofias de la membrana de Bowman (Reis-Bücklers y Thiel-Behnke) también se han asociado a mutaciones del gen TGFBI.
La distrofia granular tipo 1 aparece en edades tempranas y se caracteriza por opacidades con forma de grumos localizados en la parte central de la córnea en el estroma anterior. Inicialmente, la visión no está comprometida debido a espacios de córnea clara entre los depósitos. La agudeza visual puede empeorar conforme los depósitos vayan aumentando y confluyendo en el estroma anterior.
Con el paso del tiempo, estas opacidades pueden confluir e incluso extenderse al estroma posterior. Incluso pueden ocasionar erosiones recurrentes, aunque es menos frecuente que los que se observan en la distrofia corneal de Lattice.
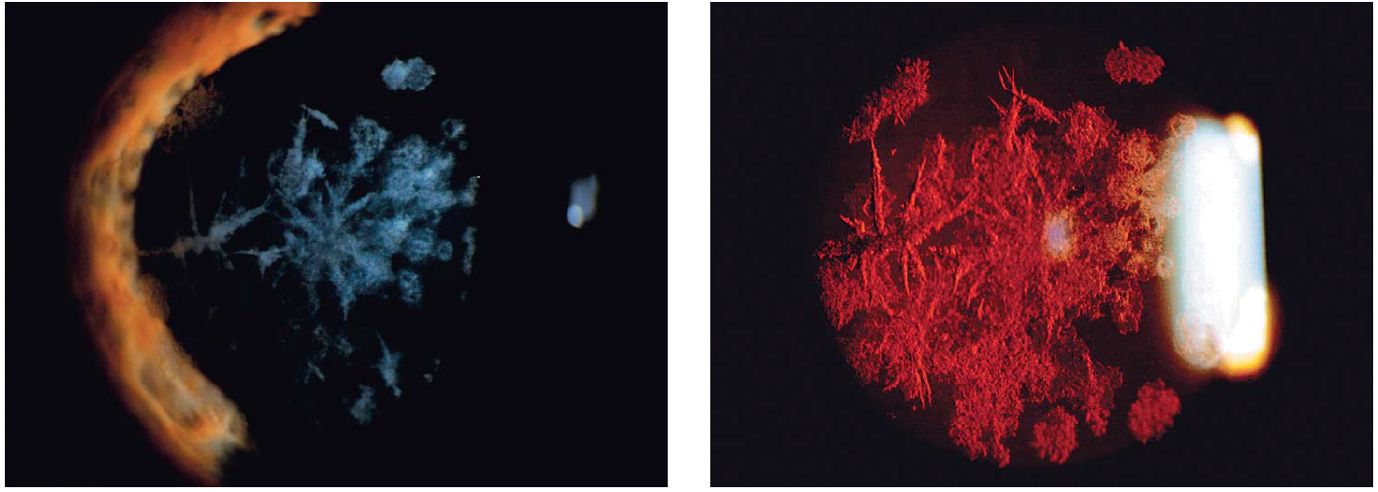
Estos depósitos se caracterizan histopatológicamente por ser de material hialino y por poseer una tinción roja con la tinción tricrómica de Masson.
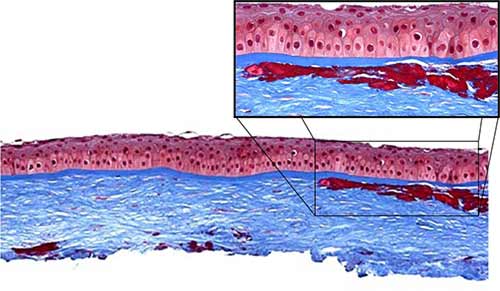
LASIK, PRK y PTK en la distrofia corneal granular tipo 1-Groenow (DCG1)
Hasta ahora, no se ha demostrado la eficacia de LASIK y PRK en pacientes con DCG1. En cambio, si se ha demostrado la eficacia de PTK. Sietz et al. observaron que los depósitos corneales de pacientes con DCG1 eran más superficiales que las opacidades en la distrofia reticular (Lattice) (profundidad media 29mm vs 79mm), sugiriendo que la PTK podría ser más efectiva en la distrofia granular que en la distrofia reticular(7).
Dighiero et al. llevaron a cabo PTK en 27 ojos con GCD1 y observaron que todos los pacientes mejoraron su agudeza visual (AV). La agudeza visual mejor corregida media (AVMCM) preoperatoria era de 20/100, y la postoperatoria tras un año de 20/30(8).
Das et al. intervinieron 62 ojos que padecían de GCD1 mediante PTK y demostraron una mejoría de la AV en 79% de los pacientes. Similar a la distrofia de Lattice, las recurrencias son frecuentes en GCD1. En este estudio, se observaron recurrencias hasta en el 20% de los pacientes tras PTK. Afortunadamente, estas recidivas tienden a localizarse en la córnea anterior, por ello siendo susceptibles a una nueva sesión de PTK(9).
Las distrofias estromales asociadas a la mutación TGFBI (Reis-Bücklers, Thiel Behnke, Lattice y granular) pueden ser asintomáticas y difíciles de detectar. Sin embargo, cualquier cirugía puede agravar la enfermedad. Tanto LASIK como PRK incrementan los productos de depósito de TGFBI y pueden reducir la AV postoperatoria. Vroman et al(10) obtuvieron estos resultados, recomendando que tanto PRK como LASIK deberían estar contraindicadas en las distrofias estromales con mutaciones en gen TGFBI.
Tras un trasplante corneal, estos depósitos pueden aparecer de nuevo. En algunas distrofias estromales, PTK puede retrasar la queratoplastia tras ablacionar los depósitos corneales. Por ello, pacientes con distrofias corneales anteriores pueden ser susceptibles a PTK/PRK cuando la localización de las opacidades es anterior(11, 12).
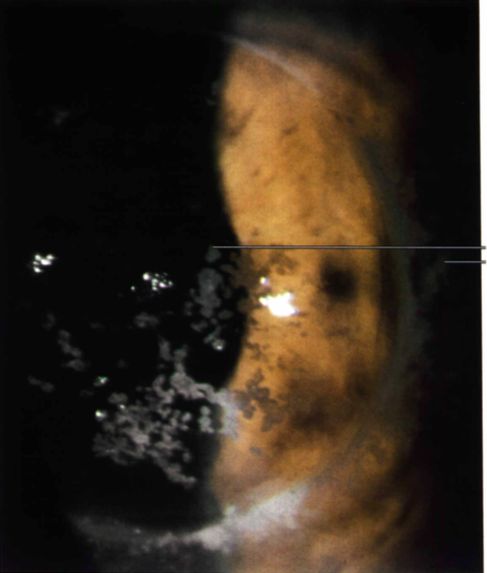
LASIK, PRK y PTK en la distrofia corneal granular tipo 2 (estromal combinada granular y reticular, Avellino)
La distrofia corneal granular tipo 2, también conocida como distrofia combinada granular y reticular de Avellino, presenta características clínicas e histopatológicas de ambas distrofias granular y reticular. Durante muchos años, se ha considerado como una variante leve de la distrofia corneal granular tipo 1(13).
En 1988, Folberg et al. describieron cuatro pacientes con depósitos hialinos y amiloides, inicialmente pensando que se trataba de una distrofia granular. En 1992, los hallazgos clínicos de estos pacientes se describieron en una familia de pacientes originarios de Avellino (Italia), dando lugar al nombre de esta distrofia(13).
Siendo causada por la mutación Arg124His en el gen TGFBI, esta distrofia se presenta en las primeras dos décadas de vida como opacidades grumosas granulares y por ello puede ser confundida como la distrofia granular. Las opacidades lineales típicas de la distrofia reticular de Lattice aparecen más tarde. En paciente homocigóticos para la mutación Arg124His, los hallazgos clínicos aparecen en edades más tempranas y de manera más severa(13).
Existe abundante literatura sobre la exacerbación de la distrofia de Avellino tras Lasik(13).
Kim et al compararon pacientes con distrofia de Avellino heterocigóticos tras intervenirse de LASIK vs PRK. Observaron una alta tasa recurrencia de las opacidades en la interfase en aquellos intervenidos mediante LASIK, mientras que aquellos intervenidos mediante PRK tenían recurrencias más leves(14).
Lee et al. también observaron recurrencias en pacientes con esta distrofia tras LASEK, a pesar de usar MMC. Su conclusión fue recomendar la contraindicación de LASEK en esta distrofia(15).
Aunque numerosos estudios sugieren que la ablación corneal exacerba las opacidades, puede ser necesario recurrir a la PTK en ciertos casos para prevenir o retrasar un trasplante corneal en pacientes con haze estromal difuso.
Inoue et al. observó que los pacientes homocigóticos para la mutación Arg124His tenían una recurrencia media de 9.5 +/- 3.1 meses frente a los 38.4 +/-6.2 meses en aquellos pacientes heterocigóticos. Además, las opacidades en los pacientes homocigóticos eran más grandes y difusos frente a las opacidades pequeñas, localizadas y discretas en pacientes heterocigóticos. Se concluyó por ello que las pruebas genéticas son de gran interés en el pronóstico y eficacia de la PTK en estos pacientes(16).
Jung et al. emplearon la FD-OCT (dominio de Fourier) para determinar la mínima cantidad de tejido que debe ser ablacionada en pacientes con haze estromal difuso asociado a la distrofia de Avellino. En su estudio de 29 ojos, la profundidad media era de 44.3 +/- 6.4 mm, siendo la profundidad media de ablación 44.5+/-5.9mm. La mejoría en la AVMC tras PTK era estadísticamente significativo y los pacientes no requirieron una segunda sesión de PTK por recurrencia o exacerbación de las opacidades tras 21 meses de seguimiento. Se concluyó que la PTK puede emplearse con precaución para mejorar la AV y retrasar un posible trasplante corneal en pacientes con distrofia de Avellino(17).
Uso de la MMC
La MMC se ha empleado para modular la cicatrización tras PRK y PTK e intentar reducir el haze estromal postoperatorio. Su rol en la PTK empleada para distrofias estromales anteriores está aún por esclarecer.
Kim et al fueron los primeros en publicar el uso de MMC tras PTK en pacientes con distrofia de Avellino (tres casos recurrentes, un caso primario). No observaron una recurrencia de las opacidades en pacientes que eran heterocigóticos para la mutación Arg124His. Sin embargo, los 2 pacientes que eran homocigóticos para esta mutación si experimentaron recurrencias, aunque leves, logrando una AVMC de 20/30(18).
Un estudio más reciente de Ha et al. comparó diez pacientes con distrofia de Avellino que se sometieron a PTK y MMC frente a otros diez que sólo se intervinieron de PTK. Sus resultados mostraron ningún beneficio del uso de la MMC en la prevención de la exacerbación o recurrencia de la enfermedad(19).
Conclusión
Todo paciente debe ser minuciosamente historiado y explorado para descartar una posible distrofia corneal previo a cualquier opción de cirugía refractiva. Se puede realizar LASIK y PRK con cautela en algunas distrofias corneales, pero están contraindicadas en otras.
La cirugía LASIK está contraindicado en la distrofia de la membrana basal, siendo la PRK la opción más recomendable. Cualquier opción de cirugía refractiva debe ser evitada en pacientes con distrofia corneal combinada granular y reticular (Avellino), ya que están en riesgo de exacerbación de la enfermedad tras LASIK y PRK. La cirugía LASIK también debe de ser evitada en corneas con guttas ya que puede exacerbar incluso las formas más leves de la enfermedad(20), y la seguridad de la PRK aún no se ha establecido en pacientes con distrofia endotelial de Fuchs. Tanto LASIK como PRK parecen ser seguros como tratamiento de formas leves de distrofia polimorfa posterior.
Hasta ahora, no existe evidencia científica que demuestre que PRK y LASIK sean seguros y eficaces en el tratamiento de las distrofias corneales granulares por lo que es necesario que se lleven a cabo futuros estudios. Además, se insiste que estas opciones deben de ser evitadas en pacientes con distrofia corneal de Avellino y en aquellos con mutaciones del gen TGFBI.
Las ideas planteadas en el foro son muy interesantes, debatiendo que, atendiendo a las necesidades del paciente, muchos profesionales optan por un enfoque fotorrefractivo. En cambio, otros expertos optan por un tratamiento fototerapéutico debido a la patología de base del paciente.
REFERENCIAS
- Weiss JS, Moller HU, Lisch W, et al. The IC3D classification of the corneal dystrophies. Cornea. 2008;27(Suppl 2):S1e83
- Musch DC, Niziol LM, Stein JD, et al. Prevalence of corneal dystrophies in the United States: estimates from claims data. Invest Ophthalmol Vis Sci. 2011;52:6959e63
- Stasi K, Chuck RS. Update on phototherapeutic keratectomy. Curr Opin Ophthalmol. 2009;20:272e5
- Dinh R, Rapuano CJ, Cohen EJ, et al. Recurrence of corneal dystrophy after excimer laser phototherapeutic keratectomy. Ophthalmology. 1999;106:1490e7
- Ratanasit A, Gorovoy MS. Laser-assisted in situ keratomileusis or photorefractive keratectomy after Descemet’s stripping automated endothelial keratoplasty. Cornea. 2011;30:787e9
- Chao-Shern C, Me R, DeDionisio LA, et al. Post-LASIK exacerbation of granular corneal dystrophy type 2 in members of a chinese family. Eye (Lond). 2018;32(1):39–43. doi:10.1038/eye.2017.26
- Seitz B, Behrens A, Fischer M, et al. Morphometric analysis of deposits in granular and lattice corneal dystrophy: histopathologic implications for phototherapeutic keratectomy. Cornea. 2004;23:380e5
- Dighiero P, Ellies P, Legeais JM, et al. [Phototherapeutic keratectomy in the treatment of Groenouw’s type I corneal dystrophy]: J Fr Ophtalmol. 1999;22:176e9
- Das S, Langenbucher A, Seitz B. Excimer laser phototherapeutic keratectomy for granular and lattice corneal dystrophy: a comparative study. J Refract Surg. 2005;21:727e31
- Vroman DT, Solomon KD, Holzer MP, et al. Endothelial decompensation after laser in situ keratomileusis. J Cataract Refract Surg 2002; 28:2045–2049
- Droutsas D, Tsioulias G, Kotsira J, et al. Phototherapeutic keratectomy in macular corneal dystrophy with recurrent erosions. J Refract Surg. 1996;12:S293–4.
- Wagoner M, Badr I. Phototherapeutic keratectomy for macular corneal dystrophy. J Refract Surg. 1999;15:481–4.
- Woreta FA, Davis GW, Bower KS. LASIK and surface ablation in corneal dystrophies. Surv Ophthalmol. 2015 Mar-Apr;60(2):115-22.
- Kim TI, Pak JH, Chae JB, et al. Mitomycin C inhibits recurrent Avellino dystrophy after phototherapeutic keratectomy. Cornea. 2006;25:220e3
- Lee JH, Stulting RD, Lee DH, et al. Exacerbation of granular corneal dystrophy type II (Avellino corneal dystrophy) after LASEK. J Refract Surg. 2008;24:39e45
- Inoue T, Watanabe H, Yamamoto S, et al. Recurrence of corneal dystrophy resulting from an R124H Big-h3 mutation after phototherapeutic keratectomy. Cornea. 2002;21:570e3
- Jung SH, Han KE, Stulting RD, et al. Phototherapeutic keratectomy in diffuse stromal haze in granular corneal dystrophy type 2. Cornea. 2013;32:296e300
- Kim TI, Pak JH, Chae JB, et al. Mitomycin C inhibits recurrent Avellino dystrophy after phototherapeutic keratectomy. Cornea. 2006;25:220e3
- Ha BJ, Kim TI, Choi SI, et al. Mitomycin C does not inhibit exacerbation of granular corneal dystrophy type II induced by refractive surface ablation. Cornea. 2010;29:490e6
- Dastjerdi MH, Sugar A. Corneal decompensation after laser in situ keratomileusis in Fuchs’ endothelial dystrophy. Cornea. 2003;22:379e81
AUTORES

Rahul Rachwani Anil
– Hospital Regional Universitario de Málaga

Carlos Rocha de Lossada
– Fellowship de córnea y segmento anterior en el Hospital Clinic de Barcelona

Rahul Rachwani Anil
– Hospital Regional Universitario de Málaga

Carlos Rocha de Lossada
– Fellowship de córnea y segmento anterior en el Hospital Clinic de Barcelona