OBJETIVO
Artículo de revisión sistemática en el que se compara la cirugía mediante femtoláser (FLACS) vs la cirugía convencional de facoemulsificación (PCS).
DATOS A DESTACAR DEL ARTÍCULO
TAMAÑO DE LA CAPSULOTOMÍA:
Se ha determinado biomecánicamente que el tamaño ideal de una capsulotomía es de 5.25 mm [Packer] y que esta, es desarrollada de forma más precisa mediante FLACS (actualmente también mediante Zepto) que con la tradicional CCC de la PCS. Sin embargo que esto se traduzca en beneficios en mundo real, por ejemplo en una mejor posición efectiva de la lente (ELP), queda todavía en el aire. El estudio de Panthier y cols demostró que aunque las capsulotomías mediante FLACS son más precisas y menos modificadas con el tiempo (1 año), esto no mejoró la ELP ni la calidad visual.
Actualización sobre complicaciones intra y postoperatorias:
- A) MIOSIS
Chen y cols en su ensayo clínico controlado aleatorizado confirmaron que el uso previo a la cirugía de catarata de AINES tópicos previene la miosis induciada por el FLACS y maniene una estabilidad pupilar intraoperatoria al disminuir los nivles de PG E2.
- B) DESGARROS RADIALES EN LA CÁPSULA ANTERIOR Y DESGARROS EN LA CÁPSULA POSTERIOR
Lua y cols realizaron un estudio con microscopía de fuerza atómica (AFM) para probar las propiedades biomecánicas de la capsulotomía FLACS versus PCS CCC y demostraron que el esters se distribuía uniformemente por toda la circunferencia mediante la técnica PCS CCC mientras que zonas de alto estrés se observavan en diferentes zonas de la rexis mediante FLACS, lo que parece que predispone a una mayor probabilidad de desgarros anteriores.
En el metaanálisis de Popovic y cols también se observó un mayor porcentaje de desgarros capsulares posteriores mediante FLACS.
- C) TRAUMATISMO CORNEAL
Los resultados del metaanálisis de Popovic demonstraron una diferencia significativa a favor del FLACS sobre PCS en la reducción del tiempo efectivo de facoemulsificacion, en el espesor corneal central postoperatorio, y en la pérdida de células endoteliales. Estos resultados pueden apoyar el uso de FLACS en pacientes con bajo contaje endotelial o con distrofias endoteliales.
- D) FLARE
Una concentración mayor de prostaglandinas, que son un marcador inflamatorio, se han econtrado en FLACS al compararlo con PCS. [Popovic y cols].
- E) EDEMA MACULAR CÍSTICO (EMC)
Ewe en su estudio de cohores comparativas identificó una mayor tasa de EMC después de FLACS vs PCS siendo ligeramente estadísticamente significativo.
- F) OPACIFICACIÓN DE LA CÁPSULA POSTERIOR (OCP)
Wertheimer y cols. reportaron que la fomación de OCP no estaba relacionada con la técnica quirúrgica en cuanto a la extracción de la catarata (FLACS vs PCS). Sin embargo el estudio EUREQUO encontró que la tasa de OCP era mayor en FLACS.
- G) PRESIÓN INTRAOCULAR
El estudio EUREQUO encontró tasas más altas de PIO incontrolada mediante FLACS vs PCS (0.2 vs. 0%).
- H) RESULTADOS VISUALES Y REFRACTIVOS
En el estudio EUREQUO, Manning y cols, encontraron que la cirugía FLACS no obtenía unos resultados visuales ni refractivos mejores que mediante PCS [ EUROQUO]. El metaanálisis de Popovic obtiene resultados similares. Panthier y cols al comparar la forma de la capsulotomía, su cambio y su impacto en la calidad de vida 1 año post FLACS y/o post PCS en ojos pareados (un ojo FLACS y el otro PCS) encontraron que a pesar de obtener una capsulorrexis más precisa mediante FLACS, tampoco encontraron diferencias en cuanto a la agudeza visual a distancia, al error refractivo ni a la ELP.
- I) MANEJO DEL ASTIGMATISMO
En pacientes con implantación de LIOs tóricas Oakley encontró mejoras similares en término de ganancia de letras en ambas técnicas (FLACS y PCS), sugiriendo que el beneficio teórico del FLACS en la creación de la rexis que llevaría a una mejor y más estable alineación de la lente tórica no se traduce en una mejoría en la visión de los pacientes.
CONSIDERACIÓN EN CUANTO AL COSTE:
El bajo equilibrio entre el coste y la efectividad del FLACS sigue siendo el mayor obstáculo para la mayor dispersión en el uso de esta tecnología.
CONCLUSIÓN
- La cirugía mediante FLACS puede originar complicaciones. Los estudios actuales y los metaanálisis sugieren un mayor índice de complicaciones en FLACS vs PCS.
- Los estudios comparativos desarrollados han demostrado únicamente que la cirugía FLACS es ‘NO INFERIOR’ al compararla con la cirugía PCS incluso para casos ‘complejos’ dónde se busca un resultado visual y refractivo muy exacto y No ha demostrado actualmente ser superior.
Otras referencias recomendadas (artículo 1)
- Packer M, Teuma EV, Glasser A, et al. Defining the ideal femtosecond laser capsulotomy. Br J Ophthalmol 2015; 99:1137 – 1142.
- Panthier C, Costantini F, Rigal-Sastourne JC, et al. Change of capsulotomy over 1 year in femtosecond laser-assisted cataract surgery and its impact on visual quality. J Refract Surg (Thorofare NJ: 1995) 2017; 33:44 – 49. )
- Lua MR, Oertle P, Camenzind L, et al. Superior rim stability of the lens capsule following manual over femtosecond laser capsulotomy. Invest Ophthalmol Vis Sci 2016; 57:2839–2849).
- Popovic M, Campos-Moller X, Schlenker MB, et al. Efficacy and safety of femtosecond laser-assisted cataract surgery compared with manual cataract surgery: a meta-analysis of 14 567 eyes. Ophthalmology 2016; 123: 2113 – 2126.
- Wertheimer C, Kreutzer TC, Dirisamer M, et al. Effect of femtosecond laser- assisted lens surgery on posterior capsule opacification in the human capsular bag in vitro. Acta Ophthalmol 2017; 95:e85 – e88 )
- Chen H, Lin H, Chen W, et al. Topical 0.1% bromfenac sodium for intraoperative miosis prevention and prostaglandin E2 inhibition in femtosecond laser-assisted cataract surgery. J Ocular Pharmacol Therap 2017; 33: 193 – 201).
- Scott WJ, Tauber S, Gessler JA, et al. Comparison of vitreous loss rates between manual phacoemulsification and femtosecond laser-assisted cataract surgery. J Cataract Refract Surg 2016; 42:1003 – 1008).
- Ewe SY, Abell RG, Oakley CL, et al. A Comparative cohort study of visual outcomes in femtosecond laser-assisted versus phacoemulsification cataract surgery. Ophthalmology 2016; 123:178 – 182)
- Manning S, Barry P, Henry Y, et al. Femtosecond laser-assisted cataract surgery versus standard phacoemulsification cataract surgery: study from the European Registry of Quality Outcomes for Cataract and Refractive Surgery. J Cataract Refract Surg 2016; 42:1779 – 1790.)
- Oakley CL, Ewe SY, Allen PL, et al. Visual outcomes with femtosecond laser-assisted cataract surgery versus conventional cataract surgery in toric IOL insertion. Clin Exp Ophthalmol 2016; 44:570 – 573.
- Chang DF, Mamalis N, Werner L. Precision pulse capsulotomy: preclinical & safety and performance of a new capsulotomy technology. Ophthalmology 2016; 123:255 – 264. A novel device that safely and effectively performs anterior capsulotomy using a disposable handpiece, at a fraction of the cost of FLACS.16.
- Thompson VM, Berdahl JP, Solano JM, et al. Comparison of manual, femto-second laser, and precision pulse capsulotomy edge tear strength in paired human cadaver eyes. Ophthalmology 2016; 123:265 – 274.
Objetivo
Este artículo estudia el uso de la toxina botulínica A (BTX-A) en el tratamiento de la epífora y del ojo seco.
Datos a destacar del artículo
La toxina botulínica A (BTX-A) está aprobada para el tratamiento del blefaroespasmo, espasmo hemifacial y de las arrugas glabelares. El uso de BTX-A ha aumentado exponencialmente en las últimas décadas, tanto en indicaciones on-label como off-label.
Mecanismo de acción
La glándula lagrimal es una glándula exocrina y está inervada principalmente por fibras nerviosas parasimpáticas. BTX-A inhibe la neurotransmisión inhibiendo la liberación de acetilcolina en el botón presináptico a nivel de la unión neuromuscular del músculo estriado y de las glándulas ecrinas. Su máximo efecto es a la semana de la inyección y suele tener una vida media entre 3 a 6 meses. Varias sesiones de inyecciones pueden producir atrofia, permitiendo intervalos más largos en las sucesivas sesiones. Algunos autores sugieren que el bloqueo farmacológico de BTX-A es permanente y el crecimiento de nuevas terminaciones nerviosas es lo que caracteriza su efecto temporal [Hoffman et al.]
Epífora
Las glándulas lagrimales principal y accesoria contribuyen a la producción de la lágrima basal y refleja. La epífora puede afectar la calidad de vida causando visión borrosa, irritación periocular y vergüenza social. La obstrucción del conducto nasolagrimal es una de las causas más frecuentes de epífora y su abordaje suele ser la dacriocistorrinostomía.
Demetriades et al. demostró un descenso en la producción de la capa acuosa de la lágrima al inyectar BTX-A en la glándula lagrimal principal y accesoria en animales. Por tanto, este procedimiento constituye una opción terapéutica no quirúrgica de la obstrucción lagrimal en pacientes ancianos que pudiesen presentar alguna contraindicación a la cirugía [Ziahosseini et al]. También será una buena opción en pacientes no dispuestos a someterse a tratamientos agresivos. [Kaynak et al]
Existen otras causas de epífora que pueden tratarse con BTX-A como son la epífora funcional y el síndrome de las lágrimas de cocodrilo. En esta última, la epífora es consecuencia de una reinervación aberrante de fibras nerviosas vegetativas de la glándula salival y de la masticación que se dirigen erróneamente hacia la glándula lagrimal. Estímulos salivales producirán epífora.
La inyección intraglandular de BTX-A en el tratamiento de la epífora es una indicación off-label y precisa del consentimiento del paciente.
Ojo seco
Curiosamente, BTX-A se puede utilizar para una indicación opuesta a la epífora, el ojo seco. Basado en la acción de debilitar el músculo orbicular, se puede lograr una disminución del drenaje lagrimal al actuar sobre las fibras musculares que actúan sobre los canalículos superiores e inferiores, y por ende disminuyendo el parpadeo y la bomba lagrimal.
La técnica consiste en inyectar BTX-A subcutáneo en la porción medial palpebral inferior cerca del punto lagrimal, dirigida hacia el tendón cantal medial. Esto causa una disminución del parpadeo horizontal con mínima retracción. La inyección en la porción medial palpebral superior causa menor parpadeo con retracción.
El drenaje lagrimal se redujo hasta el 52% a las 3 semanas en pacientes con una sóla inyección palpebral. El drenaje se reestableció a las 12 semanas de media [Sahlin et al].
Por ello, BTX-A puede ser una alternativa a la oclusión del punto lagrimal para reducir el drenaje lagrimal. Un ensayo clínico ha demostrado una mayor mejoría en la calidad de vida y de satisfacción del paciente en pacientes tratados con BTX-A en comparación con tapones lagrimales [Bukhari et al]
Concentración, dosis y técnica
Existen dos presentaciones de BTX-A, onabotulinumtoxinA (Botox, Allergan) y abobotulinumtoxinA (Dysport, Ipsen Biopharm). Ambas no son intercambiables puesto que se precisa el doble de dosis de abobotulinumtoxinA para inducir el mismo efecto que onabotulinumtoxinA. [Kutschenko et al].
La concentración de BTX-A se mide en unidades (IU) por 0,1ml. La dilución de 2ml de suero salino al 0,9% con onabotulinumtoxinA da una concentración de 50 IU/1 ml.
La dosis inicial para la inyección intraglandular suele ser 2,5 IU y se va aumentando en las sucesivas intervenciones. No existe una relación lineal entre la dosis utilizada y la duración del efecto [Girard et al].
La intervención se puede realizar en una consulta esterilizada. Existen dos vías de abordaje. La vía transcutánea consiste en inyectar BTX-A en el lóbulo orbitario de la glándula lagrimal mediante una aguja de 30G previa anestesia tópica y asepsia. La vía transconjuntival consiste en inyectar la toxina en el lóbulo palpebral bajo visualización directa de la glándula, y por tanto permitiendo usar dosis menores. Esta vía de abordaje es la que se recomienda debido a su menor tasa de complicaciones [Falzon et al].
Se ha demostrado un descenso en la producción lagrimal mediante BTX-A intraglandular con concentraciones de 1,25 y 2,5 IU comparado con suero fisiológico intraglandular. Hasta el 87% de los pacientes notaron mejoría sintomática basándose en la escala subjetiva de Munk y objetivamente mediante el test de Schirmer. Aún así, estos métodos se consideran imprecisos a la hora de evaluar la producción lagrimal.
Aún no se ha establecido la dosis exacta de BTX-A para lograr una recuperación completa. Dosis mayores de 2,5 IU logran la misma mejoría que dosis de 2,5 IU y por tanto dosis mayores no consiguen mayor eficacia o duración, aunque si pueden producir más complicaciones como la ptosis. [Girard et al]
Complicaciones oculares
Destacan la ptosis y el estrabismo debido a la difusión de la toxina a las estructuras que circundan la glándula lagrimal. La ptosis palpebral transitoria es la complicación más frecuente con incidencias hasta del 13% [Wojno et al]. Suele ser leve y resolver espontáneamente a las 3 semanas tras su administración. Inyecciones con menor dosis y más volumen de BTX-A resulta en una mayor difusión hacia tejidos no diana.
No se ha visto que BTX-A intraglandular para el tratamiento de la epífora provoque ojo seco [Girard et al]. Sin embargo, si se sabe que cuando es utilizado para el tratamiento de las arrugas orbitarias laterales (patas de gallo) si pueden agravar los síntomas en pacientes con ojo seco. Esto se produce por la difusión de la toxina a la glándula lagrimal disminuyendo la producción lagrimal.
Conclusiones
BTX-A tiene indicaciones, hasta ahora off-label, para el tratamiento de la epífora y el ojo seco. El conocimiento de la dosis, lugar de administración y selección de pacientes va a ser importante para evitar complicaciones.
Otras referencias recomendadas (artículo 2)
- Ziahosseini K, Al-Abbadi Z, Malhotra R. Botulinum toxin injection for the treatment of epiphora in lacrimal outflow obstruction. Eye 2015; 29:656–661.Kaynak P, Karabulut GO, Ozturker C, et al. Comparison of botulinum toxin-A injection in lacrimal gland and conjunctivodacryocystorhinostomy for treatment of epiphora due to proximal lacrimal system obustruction. Eye 2016; 30:1056–1062.
- Tu AH, Chang EL. Botulinum toxin for palliative treatment of epiphora in a patient with canalicular obustruction. Am Acad Ophthalmol 2005; 112:1469–1471.
- Girard B, Piaton JM, Keller P, et al. Botulinum neurotoxin injection for the treatment of epiphora in nasolacrimal duct obstruction. J Fr Ophthalmol 2017; 40:661–665.
- Sahlin S, Chen E, Kaugesaar T, et al. Effect of eyelid botulinum toxin injection on lacrimal drainage. Am J Ophthalmol 2000; 129:481–486.
- Serna-Ojeda JC, Nava-Castaneda A. Paralysis of the orbicularis muscle of the eye using botulinum toxin type A in the treatment for dry eye. Acta Ophthalmol 2017; 95:e132–e137.
Objetivo
La disbiosis intestinal ha sido asociada a enfermedades poligénicas de base inmune. Este artículo resume los mecanismos por los cuales la microbiota intestinal contribuye a la enfermedad ocular inflamatoria, y como podemos actuar sobre ella para lograr un beneficio terapéutico.
Datos a destacar del artículo
El microbioma se define como la comunidad de microorganismos y su material genético. Gran parte de este microbioma está localizado en el tracto gastrointestinal, lugar dónde se ubica una gran parte del sistema inmune del ser humano. No es de extrañar, por tanto, que parece haber una asociación entre la disbiosis intestinal y varias enfermedades inmunes como la esclerosis múltiple [Costello et al].
La patogénesis de la uveítis de causa inmune no está del todo esclarecida. Muchas de las enfermedades convergen en la activación de la cascada inflamatoria y de numerosas interleucinas, siendo estas últimas el objetivo principal en el tratamiento. Sin embargo, no se conoce muy bien cuáles son los desencadenantes de la uveítis.
Existen estirpes bacterianas, como las filamentosas segmentadas, que promueven la diferenciación de los linfocitos T helper 17 (Th17) en el intestino. Éstos linfocitos pueden volverse patogénicos y se han asociado a la uveítis [Tan et al]
Cambios en la microbiota intestinal en enfermedades autoinmunes extraintestinales
- Artritis Reumatoide. Se ha encontrado un aumento en las poblaciones de la bacteria Prevotella copri, normalmente bajas en personas sanas, una disminución de bacterias Bacteriodes beneficiosas [Scher et al]
- Esclerosis Múltiple. Se ha demostrado una depleción sustancial de colonias de Clostridia. Éstas promueven la diferenciación de células T reguladoras (Tregs). En ensayos clínicos con animales se ha visto como cambios en el microbioma intestinal modifican la severidad de la enfermedad. Así, el uso de antibióticos de amplio espectro han logrado reducir la inflamación en el sistema nervioso central [Miyake et al]
- Espondilitis Anquilosante. Estos pacientes y otros con otro tipo de espondiloartropatía tienen una inflamación gastrointestinal subclínica. Estudios con animales han demostrado que aquellos que expresan HLA-B27 tienen una reducción de bacterias beneficiosas Rikenellaceae y un aumento de Paraprevotella. Existe la hipóstesis de que HLA-B27 altera la microbiota intestinal interfiriendo con la inmunidad del tejido linfoide asociado al intestino (GALT). [Lin et al]
El eje intestino-ocular. Microbiota y uveítis
La gravedad de la uveítis parece estar asociada al crecimiento de una serie de cepas bacterianas como son Coprococcus, Dorea, Adlecreutzia y Desulfovibrio, en estudios con animales. La intensidad del cuadro mejoró tras administrar metronidazol o vancomicina, puesto que tienen cobertura frente a estas bacterias. El uso de antibióticos de manera sucesiva y sistemática no redujo la gravedad de las crisis ya que los antibióticos carecen de efecto antiinflamatorio. [Nakamura et al]
Se hipotetiza el mimetismo entre la retina y un antígeno bacteriano como desencadenante de la uveítis, ya que en modelos animales moleculares se precisa de dicho antígeno para la activación de células T específicos de la retina. [Horai et al]
En la primera fase de la uveítis, previa a los signos de inflamación intraocular, se han descrito cambios morfológicos, bioquímicos y aumento de la permeabilidad a nivel intestinal. Posteriormente, existe un aumento en las colonias de Prevotella y un aumento del flujo de interleucinas desde el tracto gastrointestinal hacia el ojo y el bazo como Th1 y Th17. El número de leucocitos en el ojo derivados del intestino se correlacionó con mayor gravedad del cuadro [Nakamura et al]
Por otro lado, la administración de ácidos grasos de cadena corta derivados de bacterias intestinales beneficiosas, han demostrado mejorar el cuadro de uveítis aumentando el número de células T reguladoras y disminuyendo el flujo de leucocitos desde el intestino hacia el bazo [Nakamura]. Estos resultados sugieren que la restauración de la homeostasis intestinal puede ser un método efectivo para controlar la uveítis.
Estos estudios tienen limitaciones en estudiar la asociación entre causa y efecto puesto que se han utilizado modelos animales.
El eje intestino-ocular. Microbiota y degeneración macular asociada a la edad (DMAE)
El único tratamiento que ha demostrado aminorar la progresión de la DMAE son los suplementos de antioxidantes y carotenoides que intervienen en la biosíntesis de fotorreceptores. Estos suplementos estudiados en el AREDS2 (age related eye disease study 2) tienen la capacidad de alterar la microbiota intestinal. Se han encontrado un aumento de las colonias de Prevotella y una reducción de las bacterias beneficiosas Ruminococcaceae y Rickenellaceae en pacientes con DMAE. Existe un aumento de las colonias Peptoniphilius en paciente con DMAE que toman suplementos.
Abordaje terapéutico de la microbiota en el tratamiento de la enfermedad ocular inflamatoria
Existen cinco estrategias terapéuticas:
- Tratar las posibles bacterias causales. Se puede lograr mediante técnicas especfícias como inmunoglobulinas que atacan dichas bacterias o sus componentes, respetando las bacterias beneficiosas. [Okai et al.]
- Antibióticos específicos diseñados para actuar sobre una comunidad bacteriana específica.
- Tratamiento con probióticos de cepas bacterianas beneficiosas vía oral para aumentar la homeostasis intestinal y aumentar la diferenciación de las células T reguladoras. También se pueden administrar análogos de componentes de bacterias beneficiosas, como ácidos grasos de cadena corta. Éstos últimos han demostrado mejorar la uveítis. [Ochoa Reparaz et al.]
- Asesoramiento dietético del paciente, como aumentar la ingesta de fibras no digeribles para aumentar la producción de ácidos grasos de cadena corta
- Trasplante de microbiota intestinal. Ha demostrado curar la colitis por Clostridium difficile resistente al tratamiento antibiótico[Gough et al].
Conclusiones
La microbiota intestinal parece jugar un papel fundamental en la patogénesis de enfermedades inmunes. Aún se precisan de ensayos mejor diseñados para establecer una causa efecto. El tratamiento de una correcta homeostasis intestinal mediante ácidos grasos de cadena corta parece ser potencialmente beneficiosa. Esta última aún no se ha estudiado en pacientes con uveítis.
Otras referencias recomendadas (artículo 5)
- Miyake S, Kim S, Suda W, et al. Dysbiosis in the gut microbiota of patients with multiple sclerosis, with a striking depletion of species belonging to Clostridia XIVa and IV clusters. PLoS One 2015; 10:e0137429.
- Ochoa-Reparaz J, Mielcarz DW, Ditrio LE, et al. Role of gut commensal microflora in the development of experimental autoimmune encephalomyelitis. J Immunol 2009; 183:6041–6050
- Berer K, Gerdes LA, Cekanaviciute E, et al. Gut microbiota from multiple sclerosis patients
- enables spontaneous autoimmune encephalomyelitis in mice. Proc Natl Acad Sci U S A 2017; 114:10719–10724.
- Nakamura YK, Metea C, Karstens L, et al. Gut microbial alterations associated with protection from autoimmune uveitis. Invest Ophthalmol Vis Sci 2016; 57:3747–3758.
- Horai R, Zarate-Blades CR, Dillenburg-Pilla P, et al. Microbiota-dependent activation of an autoreactive T cell receptor provokes autoimmunity in an immunologically privileged site. Immunity 2015; 43:343–353.
- Nakamura YK, Janowitz C, Metea C, et al. Short chain fatty acids ameliorate immune-mediated uveitis partially by altering migration of lymphocytes from the intestine. Sci Rep 2017; 7:11745.
- Ochoa-Reparaz J, Mielcarz DW, Ditrio LE, et al. Central nervous system demyelinating disease protection by the human commensal Bacteroides fragilis depends on polysaccharide A expression. J Immunol 2010; 185:4101–4108.
- Gough E, Shaikh H, Manges AR. Systematic review of intestinal microbiota transplantation (fecal bacteriotherapy) for recurrent Clostridium difficile infection. Clin Infect Dis 2011; 53:994–1002.
Objetivo
Este artículo resume las características y la técnica de los dispositivos Xen e InnFocus, y la evidencia existente hasta ahora acerca de su eficacia y seguridad.
Datos a destacar del artículo
Existen varias opiniones que intentan dilucidar por qué aún los pacientes glaucomatosos siguen acabando en ceguera [Sussana et al]. A pesar de ello, la mayoría coincide en que el manejo hoy en día es subóptimo. Los implantes Xen gel e Innfocus tienen el objetivo de combinar la seguridad y reproducibilidad de las técnicas MIGS sumado al poder reductor de la PIO de la cirugía clásica del glaucoma
XEN Gel Stent
El dispositivo XEN es un stent no reabsorbible de gelatina porcina entrecruzado con glutaraldehído ha demostrado una excelente biocompatibilidad. El modelo utilizado de 45 µm de lumen ofrece una resistencia a la salida del flujo de 6-8 mmHg con una producción de humor acuoso de 2-3 µl/min. La vía de abordaje es ab-interno y se realiza una incisión inferior a 2mm en el cuadrante inferotemporal y una paracentesis de servicio superotemporal de 1mm. Previa inyección de viscoelástico, el dispositivo se implanta mediante un inyector a través de la esclera a 3mm del limbo hacia el espacio subconjuntival. Normalmente se inyecta MMC en el espacio superotemporal subconjuntival mediante una aguja de 30G. Los estudios han demostrado que la cirugía combinada de XEN y facoemulsifación es superior a la segunda de manera aislada en la reducción de la PIO y del número de medicaciones tópicas. Además, se ha comparado con la trabeculectomía siendo no inferior a ésta en cuánto fracaso en lograr valores de PIO postoperatorias óptimas [Schlenker et al].
InnFocus Microshunt
Fabricado a partir de un polímero sintético ultraestable, el dispositivo Innfocus tiene una longitud de 8,5mm,con una aleta de fijación en el centro, y un lumen de 70 µm. El abordaje es ab externo y se aplica esponjas impregnadas de MMC en el espacio subconjuntival. Tras exponer la esclera, se realiza un túnel de escleral con un microcuchillete de 1mm. Posteriormente se accede a la cámara anterior mediante una aguja de 25G. Finalmente se introduce el dispositivo y se cierra la conjuntiva tras comprobar el flujo por la boquilla posterior. La mayoría de los estudios son retrospectivos y sólo uno prospectivo ha demostrado eficacia en combinación con la facoemulsificación frente a ésta última aislada [Battle et al].
Conclusiones
- La cirugía de glaucoma precoz parece ser el futuro en el manejo del glaucoma. Estos dispositivos podrían jugar un papel fundamental en la disminución de la variabilidad de la PIO, complicaciones severas de la cirugía clásica y de la dependencia de la adherencia y de los efectos secundarios de los tratamientos.
- Aunque los resultados preliminares de eficacia y seguridad son muy prometedores, aún faltan estudios mejores diseñados y con mayor tiempo de seguimiento.
Otras referencias recomendadas (artículo 4)
- Quigley HA, Broman AT. The number of people with glaucoma worldwide in 2010 and 2020. Br J Ophthalmol 2006; 90:262–267.
- Susanna R, De Moraes CG, Cioffi GA, Ritch R. Why do people (still) go blind from glaucoma? Transl Vis Sci Tech 2015; 4:1
- Sheybani A, Dick HB, Ahmed IIK. Early clinical results of a novel ab interno gel stent for the surgical treatment of open-angle glaucoma. J Glaucoma 2016; 25:e691–e696.
- Pérez-Torregrosa VT, Olate-Pe´ rez A´ , Cerda` -Iba´ n˜ ez M, et al. Combined phacoemulsification and XEN45 surgery from a temporal approach and 2 incisions. Arch Soc Esp Oftalmol 2016; 91:415–421.
- Schlenker MB, Gulamhusein H, Conrad-Hengerer I, et al. Efficacy, safety, and risk factors for failure of standalone ab interno gelatin microstent implantation versus standalone trabeculectomy. Ophthalmology 2017; 124:1579–1588
- Batlle JF, Fantes F, Riss I, et al. Three-year follow-up of a novel aqueous humor microshunt. J Glaucoma 2016; 25:e58–e65.
Objetivo
Este artículo se basa en una revisión sistemática acerca de los antibióticos intracamerales para prevenir la endoftalmitis postoperatoria. Este ha sido uno de los motivos de gran debate en FacoElche 19.
DATOS A DESTACAR DEL ARTÍCULO
La endoftalmitis postoperatoria, aunque muy rara, es una de las complicaciones más graves, de la cirugía ocular. Según el Endophthalmitis Vitrectomy Study (EVS), los resultados visuales son a menudo pobres. Un tercio de los individuos no gana visión mejor que la de contar dedos, y según el estudio de Lalwani 50% no se recupera una AV mayor a 20/40. Un estudio más reciente informó que el 34% de los pacientes afectados lograba una una agudeza visual final de 20/200 o peor [Gower].
Existen dos mecanismos bien aceptados para que ocurra la contaminación bacteriana intraocular asociada con la cirugía de cataratas:
- La entrada de múltiples instrumentos puede portar bacterias perioculares desde los párpados, pestañas o de la superficie ocular dentro del ojo.
- Las incisiones corneales no suturadas pueden permitir el flujo retrógrado del líquido desde la superficie externa del ojo durante y después de la cirugía, hasta que se cicatriza postoperatoriamente.
A pesar de usar preoperatoriamente antibióticos y povidona yodada y a pesar de los protocolos asépticos, se ha demostrado una tasa de contaminación bacteriana intraocular del 31% [Balestrazzi].
La administración de antibióticos intracamerales al final de la cirugía está destinada a matar cualquier bacteria intraocular que pudiera haber entrada durante la cirugía. Aunque algún nivel de antibiótico intraocular puede ser obtenido con la administración tópica, una inyección intraocular directa alcanza concentraciones extremadamente altas que además pueden persistir durante muchas horas [Murphy].
En 2006, el estudio prospectivo, multicéntrico, European Society of Cataract and Refractive Surgeons (ESCRS) endophthalmitis prophylaxis study, reportó una reducción significativa de endoftalmitis con el uso intracameral de cefuroxima en un total de 16.603 pacientes. La tasa de cultivos positivos disminuyó 5.86 veces en el caso de uso de cefuroxima intracameral. En el estudio realizado en Francia (Creuzot-Garcher) sobre 6.371.242 cirugías de cataratas durante un período de 10 años (2005-2014) se concluyó que la tasa de endoftalmitis disminuyó significativamente tras la comercialización de la cefuroxima intracameral (Aprokam).
La vancomicina es un antibiótico de amplio espectro que cubre casi todos los estafilococos y estreptococos , que son las especies que más frecuentemente provocan endoftalmitis después de la cirugía de cataratas. Por lo general, se inyecta 1 mg / 0,1 ml del fármaco intracameralmente al final de la cirugía. Au y cols analizaron los datos de 2000 a 2014 y concluyeron que la profilaxis intracameral de vancomicina de rutina reducía drásticamente la incidencia de endoftalmitis en su hospital localizado en Sídney. Sin embargo se han reportado casos recientes de vasculitis retiniana oclusiva hemorrágica (Ehmann) con el uso de la vancomicina intramarea,que parece ser debido a una reacción tipo III de hipersensibilidad por lo que actualmente su uso está disminuyendo.
El moxifloxacino es una quinolona de cuarta generación que posee una excelente penetración ocular tras la administración tópica. La administración intracameral alcanza niveles bactericidas hasta de 10 veces de la concentración mínima inhibitoria (CMI). La administración intracameral de moxifloxacino a partir del fármaco tópico sin conservantes (Vigamox) es una opción válida y segura (Arshinoff). En un estudio de 617453 cirugías de catarata (Arbisser) se reportó una disminución de un 3.5 % en la tasa de endoftalmitis al usar moxifloxacino intracameral al compararlos con los pacientes a los que no se les administró.
Aunque hay cada vez más evidencia para apoyar la eficacia de la profilaxis antibiótica intracameral, el problema más importante actualmente parece ser la falta de una preparación comercialmente aprobada en la mayoría de los países, lo que explica la amplia variación mundial en su uso. Otros autores (Schwartz SG y Relhan) han expresado su preocupación de que la profilaxis con antibióticos intraoculares de rutina puede llevar a un aumento de resistencia a los medicamentos. Sin embargo otros estudios como el de Naseri argumentan que esto es muy poco probable que ocurra al ser administrado el fármaco en una sóla dosis y altamente concentrado.
Conclusión
A pesar de la creciente evidencia de que la profilaxis de rutina con cefuroxima intracameral y moxifloxacina reducen la tasa de endoftalmitis después de la cirugía de cataratas, muchos cirujanos no han adoptado actualemente esta práctica.
Otras referencias recomendadas (artículo 3)
- Results of the Endophthalmitis Vitrectomy Study. A randomized trial of immediate vitrectomy and of intravenous antibiotics for the treatment of postoperative bacterial endophthalmitis. Endophthalmitis Vitrectomy Study Group. Arch Ophthalmol 1995; 113:1479–1496.
- Lalwani GA, Flynn HW, Scott IU, et al. Acute-onset endophthalmitis after clear corneal cataract surgery (1996-2005). Clinical features, causative organisms, and visual acuity outcomes. Ophthalmology 2008; 115:473–476.
- Gower EW, Keay LJ, Stare DE, et al. Characteristics of endophthalmitis after cataract surgery in the United States Medicare population. Ophthalmology 2015; 122:1625–1632.
- Balestrazzi A, Malandrini A, Montagnani F, et al. Phacoemulsificator and sterile drapes contamination during cataract surgery: a microbiological study. Eur J Ophthalmol 2012; 22:188–19
- Murphy CC, Nicholson S, Quah SA, et al. Pharmacokinetics of vancomycin following intracameral bolus injection in patients undergoing phacoemulsification cataract surgery. Br J Ophthalmol 2007; 91:1350–1353
- Barry P, Seal DV, Gettinby G, et al. ESCRS study of prophylaxis of postoperative endophthalmitis after cataract surgery: preliminary report of principal results from a European multicenter study. J Cataract Refract Surg 2006; 32:407–410.
- ESCRS Endophthalmitis Study Group. Prophylaxis of postoperative endophthalmitis following cataract surgery: results of the ESCRS multicenter study and identification of risk factors. J Cataract Refract Surg 2007; 33:978–988.
- Creuzot-Garcher C, Benzenine E, Mariet A-S, et al. Incidence of acute postoperative endophthalmitis after cataract surgery: a nationwide study in France from 2005 to 2014. Ophthalmology 2016; 123:1414–1420.
- Au CP, White AJ, Healey PR. Efficacy and cost-effectiveness of intracameral vancomycin in reducing postoperative endophthalmitis incidence in Australia. Clin Experiment Ophthalmol 2016; 44:803–811.
- Ehmann DS, Adam MK, Kasi SK, et al. Hemorrhagic occlusive retinal vasculitis and nonhemorrhagic vasculitis after uncomplicated cataract surgery with intracameral vancomycin. Retin Cases Brief Rep 2017; 11:S155–S158.
- Arshinoff SA, Modabber M. Dose and administration of intracameral moxifloxacin for prophylaxis of postoperative endophthalmitis. J Cataract Refract Surg 2016; 42:1730–1741
- Arbisser LB. Safety of intracameral moxifloxacin for prophylaxis of endophthalmitis after cataract surgery. J Cataract Refract Surg 2008; 34:1114–1120
- Schwartz SG, Flynn HW, Grzybowski A, et al. Intracameral antibiotics and cataract surgery: endophthalmitis rates, costs, and stewardship. Ophthalmology 2016; 123:1411–1413.
- Schwarz SG, Relhan N, O’Brien TP, Flynn HW Jr. A new complication associated with the use of prophylactic intracameral antibiotics: Hemorrhagic occlusive retinal vasculitis. Ophthalmology 2017; 124:578–579.
- Relhan N, Schwartz SG, Grzybowski A, Flynn HW Jr. Re: Haripriya et al.: Endophthalmitis reduction with intracameral moxifloxacin prophylaxis: an analysis of 600000 surgeries. (Ophthalmology. 2017;124:768–775) [letter].
Ophthalmology 2017; 124:e77–e78. (http://www.aaojournal.org/article/S0161-6420(17)30459-1/pdf). - Naseri A, Melles RB, Shorstein NH. Intracameral antibiotics in the shadow of hemorrhagic occlusive retinal vasculitis. Ophthalmology 2017; 124:580–582.
Objetivo
Resumir las características de las LIOs EDOF (extended depth of focus) actualmente disponibles y describir los resultados visuales y la satisfacción de los pacientes.
Con el objetivo de la independencia de gafas y una optima calidad visual postoperatoria se han desallorado las lentes EDOF cuyo principio básico es el de crear un punto focal de alargado para mejorar la profundidad de foco o el rango de visión.
DATOS A DESTACAR DEL ARTÍCULO
PRINCIPIOS ÓPTICOS:
El ojo humano está diseñado para enfocar la luz en la fóvea, pero incluso un ojo sano experimentará algún grado de aberraciones oculares, que afectan significativamente a la calidad de las imágenes visuales obtenidas en la retina [Charman]. Estas aberraciones se clasifican principalmente como monocromáticas (defocus, astigmatismo, aberración esférica y coma) o cromáticas (longitudinales y transversales). Las aberraciones monocromáticas son propiedades intrínsecas del ojo y las aberraciones de orden inferior se pueden corregir con lentes de contacto, gafas y lentes intraoculares. Sin embargo, también se ha demostrado que la corrección de las aberraciones cromáticas mejora el contraste de la imagen retiniana [Thibos y Willians]. Esto es particularmente relevante para el cirujano de cataratas, ya que trabajos previos han demostrado que la mayoría de las aberraciones cromáticas pseudofáquicas son causadas por la dispersión cromática de las LIO [Zhao].
Las lentes EDOF funcionan enfocando las ondas de luz entrantes en un plano longitudinal extendido, a diferencia de las lentes monofocales que enfocan las ondas en un solo punto o las lentes bifocales que las enfocan en dos o las multifocales que las enfocan en tres puntos. Este enfoque alargado está destinado a eliminar la superposición de imágenes cercanas y lejanas causadas por las IOL multifocales tradicionales, eliminando así el efecto de halo. Los estudios teóricos han demostrado que las lentes EDOF proporcionan una mejor calidad óptica en todo el rango de adición que las lentes multifocales y monofocales [Gallego].
Otro subtipo de LIO de profundidad de campo mejorada se denomina LIOs de apertura pequeña. Estas lentes están diseñadas con un agujero estenopeico que bloquea los rayos de luz desenfocados que potencialmente pueden disminuir la calidad de la imagen. Reducir la apertura de la pupila permite que solo la luz que entra por el centro alcance la retina, lo que da como resultado un aumento de la profundidad de enfoque de alta calidad sin zonas de transición borrosas.
LIOS EDOF DISPONIBLES:
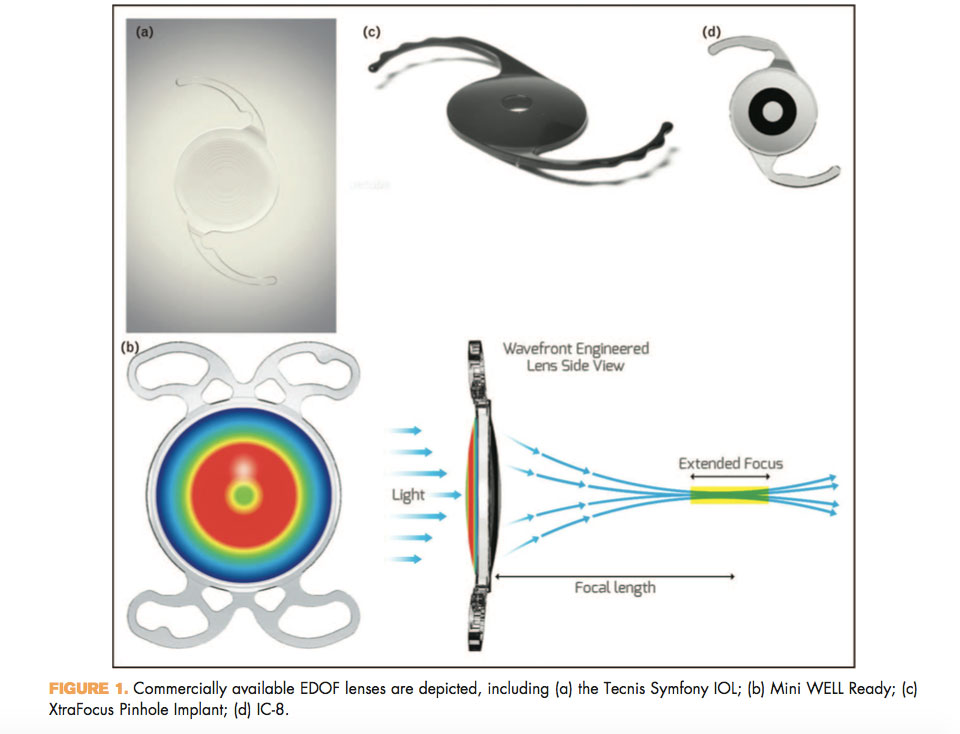
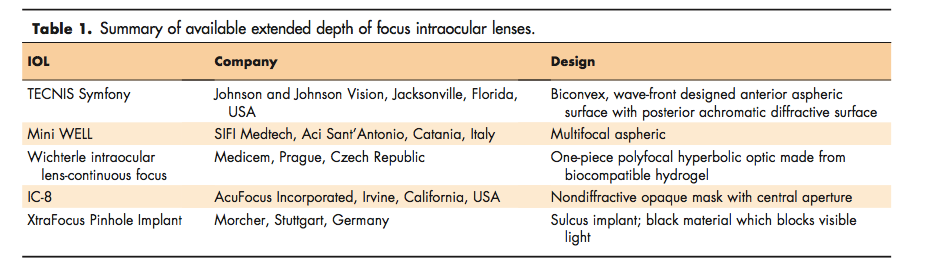
Symfony (Johnson and Johnson Vision, Jacksonville, FL):
Es una lente acrílica hidrófoba de una sola pieza, plegable, con una superficie asférica anterior biconvexa, diseñada con frente de onda, y una superficie posterior difractiva acromática con diseño de escalón (diseñada para ampliar el rango de visión con corrección de las aberraciones cromáticas). Es una lente pupilo-dependiente. Su diámetro es de 13.0 mm con una zona óptica de 6mm. Los rangos de potencia disponible son de +5.0 D a +34.0 D, con una adición de +1.75 D en el plano del IOL.
Mini WELL (SIFI, Italia): es una LIO asférica multifocal progresiva en la que se induce aberración esférica en algunas áreas específicas de la óptica de la LIO, que aumenta la profundidad de enfoque y genera una multifocalidad progresiva. La zona óptica se divide en tres anillos diferentes: las zonas interna y media tienen diferentes aberraciones esféricas con signos opuestos; La zona exterior es monofocal. El diámetro total de la lente es de 10,75 mm. Está disponible comercialmente de 0 a +30 D con una adición de +3.0 D.
WIOL-CF (Medicem, República Checa): se trata de una óptica hiperbólica polifocal de una pieza sin hápticos que se adhiere a la cápsula posterior y está diseñada para imitar las propiedades acomodativas de un cristalino ‘’joven’’. Aunque los estudios han mostrado una visión intermedia favorable no corregida [Studeny y Siatiri], los estudios de Kim y Kang demostraron un patrón constante de dislocación de la WIOL-CF en ausencia de traumatismo .
IC-8 (AcuFocus Inc, Irvine, CA) lente de cámara posterior, acrílico hidrófobo de una sola pieza, que incorpora una zona opaca de 3,23 mm de diámetro no difractiva con una apertura central de 1,36 mm. Está disponible comercialmente desde +15.5 D a +27.5 D.
XtraFocus Pinhole Implant (Morcher, Stuttgart, Alemania), destinada a la implantación en el sulcus como una lente piggyback. Está hecha de un material acrílico hidrofóbico negro que bloquea la luz visible pero es transparente a la luz infrarroja a más de 750 nm (para permitir el examen de la retina a través del material opaco con OCT y con oftalmoscopio de láser de barrido). Su diámetro total es de 14 mm con una abertura central de 1.3 mm. Se recomienda particularmente en el tratamiento del astigmatismo corneal irregular y las aberraciones de orden superior causadas por queratotomía radial, queratoplastia penetrante o queratocono
RESULTADOS:
La literatura sobre los resultados de los pacientes es relativamente limitada dada la novedad de estas lentes, pero algunos estudios muestran resultados prometedores.:
Attia y cols. analizaron 30 ojos a los que se les implantaron LIOs EDOF y los resultados mostraron excelentes agudezas visuales no corregidas tanto al cerca (0.20 logMAR), como en vision intermedia (-0.03 logMAR) como a distancia (0.03 logMAR) con altas tasas de satisfacción del paciente e independencia en el uso de gafas.
Actualmente, el único estudio multicéntrico prospectivo grande en la literatura (Cochener) se realizó en 411 pacientes con un implante bilateral de la lente Symfony. En un grupo el objetivo era la micromonovisión (-0.50 a -0.75D residual en el ojo no dominante) y en el otro grupo el objetivo era la emetropia. La micromonovisión mejoró la agudeza visual a distancia no corregida (UDVA) y la independencia de gafas así como la satisfacción del paciente en la visión cercana. En general, solo el 14,4% de los pacientes requirieron gafas después de la operación y más del 90% dijeron que recomendarían el mismo procedimiento a sus amigos y familiares. Significativamente, más del 90% de los pacientes informaron no tener deslumbramientos o ser leves, no tener halos no destellos.
De Medeiros y cols encontraron que la combinación de una lente Symfony con una LIO bifocal difractiva exhibía mejor agudeza visual a distancia no corregida pero ligeramente menor vision sin corregir al cerca (UNVA) y en vision intermedia (UIVA) que los pacientes con lentes trifocales bilaterales. Sin embargo, el grupo EDOF mixto presentaba una mejor calidad en condiciones mesópicas.
Un informe de un caso publicado recientemente mostró resultados satisfactorios en pacientes (UDVA 20/20; UIVA 20/20; UNVA 20/16) después de la implantación bilateral de la lente de Symfony en pacientes post-LASIK [Black].
Hasta la fecha, el estudio más grande de LIO IC-8 es un estudio prospectivo multicéntrico de 105 pacientes en el que se sometieron a la implantación de lentes IC-8 en un ojo y una LIO monofocal asférica en el ojo contralateral dominante. Más del 95% de los pacientes lograron una visión de 20/32 o mejor en UDVA binocular y UIVA; El 79% de los pacientes alcanzó una UNVA binocular de 20/32 o mejor. Los autores también encontraron que los pacientes con la lente IC-8 podían tolerar hasta 1.5 D de astigmatismo con una UNVA y UIVA mejor que 20/32 [Dick].
Sólo se ha publicado un estudio sobre la LIO Xtra-focus [Trindade]. A 21 pacientes pseudofáquicos con astigmatismo corneal irregular se les implantó esta lente, con una mejora estadísticamente significativa en la agudeza visual no corregida y corregida desde una mediana de 20/200 a una nueva mediana de 20/50.
CONCLUSIÓN
Los estudios parecen demostrar que las LIOs EDOF pueden proporcionar una visión cercana e intermedia satisfactoria con una reducción de la incidencia de halos y glare que sí son más acusados en las LIOs multifocales además de provocar una menor disminución de la sensibilidad al contraste. Los resultados parecen prometedores aunque siguen siendo limitados.
Otras referencias recomendadas (artículo 6)
- Charman WN. Wavefront aberration of the eye: a review. Optom Vis Sci 1991; 68:574–583.
- Thibos LN, Ye M, Zhang X, Bradley A. Effect of ocular chromatic aberration on monocular visual performance. Optom Vis Sci 1991; 68:599–607.
- WilliamsD,YoonG-Y,PorterJ,etal.Visualbenefitofcorrectinghigherorder aberrations of the eye. J Refract Surg 2000; 16:S554 – S559.
- Zhao H, Mainster MA. The effect of chromatic dispersion on pseudophakic optical performance. Br J Ophthalmol 2007; 91:1225–1229.
- Gallego AA, Bara S, Jarsozwewicz Z, Kolodziejczyk A. Visual Strehl perfor- mance of IOL designs with extended depth of focus. Optom Vis Sci 2012; 89:1702 – 1707.
- Studeny P, Krizova D, Urminsky J. Clinical experience with the WIOL-CF accommodative bioanalogic intraocular lens: Czech national observational registry. Eur J Ophthalmol 2016; 26:230 – 235.
- Siatiri H, Mohammadpour M, Gholami A, et al. Optical aberrations, accom- modation, and visual acuity with a bioanalogic continuous focus intraocular lens after cataract surgery. J Curr Ophthalmol 2017; 29:274 – 281.
- Kim YC, Kang KT, Yeo Y, et al. Consistent pattern in positional instability of polyfocal full-optics accommodative IOL. Int Ophthalmol 2017; 37:1299 – 1304.
- Kang KT, Kim YC. Dislocation of polyfocal full-optics accommodative intrao- cular lens after neodymium-doped yttrium aluminum garnet capsulotomy in vitrectomized eye. Indian J Ophthalmol 2013; 61:678–680.
- Attia MSA, Auffarth GU, Kretz FTA, et al. Clinical evaluation of an extended depth of focus intraocular lens with the Salzburg reading desk. J Refract Surg 2017; 33:664 – 669
- CochenerB;ConchertoStudyGroup.Clinicaloutcomesofanewextended range of vision intraocular lens: International Multicenter Concerto Study. J Cataract Refract Surg 2016; 42:1268 – 1275
- De Medeiros AL, de Araujo Rolim AG, Motta AFP, et al. Comparison of visual & outcomes after bilateral implantation of a diffractive trifocal intraocular lens and blended implantation of an extended depth of focus intraocular lens with a diffractive bifocal intraocular lens. Clin Ophthalmol 2017; 11:1911–1916.
- Black S. Successful restoration of visual acuity with an extended range of vision intraocular lens after multifocal laser ablation. Case Rep Ophthalmol 2016; 7:193–197.
- Dick HB, Pioevella M, Vukich J, et al. Prospective multicenter trial of a small- aperture intraocular lens in cataract surgery. J Cataract Refract Surg 2017; 43:956 – 968.
- Trindade CC, Trindade BC, Trindade FC, et al. New pinhole sulcus implant for && the correction of irregular corneal astigmatism. J Cataract Refract Surg 2017; 43:1297 – 1306
Objetivo
Se trata de una revisión sistemática de los artículos publicados entre 2016-2017 para definir los avances en la selección de la LIO
DATOS A DESTACAR DEL ARTÍCULO
La cirugía de catarata es una de las cirugías más frecuentemente realizadas en la medicina, con el avance de la ciencia es fundamental el uso de nueva tecnología para alcanzar unos resultados visuales cada vez más precisos.
AVANCES EN LA TECNOLOGÍA:
Lenstar e IOLMaster, los dos biómetros gold standard de inferometría de coherencia óptica parcial, se han comparado con el biómetro US de contacto A-scan para determinar la longitud axial (LAX) en ojos normales y en ojos miopes (-6D o más). Lenstar e IOLMaster daban valores de LAX mayores que el US (p<0.001). También se demostró que no hubo una diferencia significativa en los cálculos de poder de LIO por parte de Lenstar o IOLMaster entre ojos miopes normales y altos.
Actualemente nuevos biómetros que poseen topógrafos como Aladdin (Topcon) u OA-200 (Tomey) están ganando popularidad. Savini demostró menores variaciones del error predictive tanto en Hoffer Q como en Holladay 1 al usar Aladdin al comparar los resultados con usando Ocuscan para medir LAX y Keratron para el cáculo de la queratometría. Kongsap compare OA-200 con IOLMaster 500 encontradno una excelente correlación entre ambos, si bien es cierto que las medidas del OA-200 eran ligeramente inferiores.
SELECCIÓN DE LA FÓRMULA:
Jeong y cols al evaluar el error medio (equivalente esférico de la refracción manifiesta postoperatoria menos el error de refracción pronosticado calculado por cada fórmula), la ELP y los cambios en la ACD un mes después de la cirugía se asociaron significativamente con el error para Holladay 1, Hoffer Q y Fórmulas SRK / T pero no para la fórmula de Haigis. Los valores de K y la ACD preoperatoria no se correlacionaron con errores en ninguna de las cuatro fórmulas mencionadas anteriormente. Los autores concluyeron que en los casos en que se esperen cambios en la ACD, como en los pacientes con cataratas maduras, debilidad zonular o glaucoma de ángulo de cerrado preoperatoriamene, la fórmula de Haigis podría ser la opción más precisa.
Doshi y cols encontraron que los ojos con longitud axial corta (<22 mm) tenían un MAE significativamente más pequeño cuando utilizaban las fórmulas Hoffer Q, Holladay 1 y SRK / T en comparación con Haigis, mientras que los pacientes con longitud axial larga (> 24.5mm) no tenían una diferencia significativa en MAE entre las cuatro fórmulas. Karabela y cols demuestraron un rendimiento admirable de la fórmula SRK / T en ojos cortos (<22 mm) y largos (> 24,6 mm).
Para una longitud axial de más de 26 mm, Zhang y cols encontraron que Barrett Universal II (fórmula de quinta generación), Haigis y SRK / T tenían significativamente más pacientes con MAE +/- 0.5D 1 mes después de la operación. Barrett Universal II tenía significativamente más pacientes con MAE 0.5D en comparación con SRK / T (P <0.001) pero no Haigis lo que indica que para los ojos con longitud axial más larga, Barrett Universal II y Haigis pueden ser las mejores opciones.
CORRECIÓN DEL ASTIGMATISMO:
Los avances actuales se enfocan fundamentalmente en el estudio de la cara posterior corneal.
Zhang y cols estudiaron de forma retrospectiva a 57 pacientes que previamente se sometieron a implantación de LIO Torsal Acrysoft e encontraron que en el tercer mes del postoperatorio la magnitud del astigmatismo total, que representa el astigmatismo corneal anterior y posterior, fue de 0,44 D +/- 0.26D menor que el astigmatismo queratométrico calculado a partir únicamente de la cara anterior.
Rydstrom y cols demostraron que el astigmatismo queratométrico generalmente sobreestimaba el poder del astigmatismo WTR mientras subestima el poder del astigmatismo ATR. En este estudio el astigmatismo de la cara posterior representó más de un tercio del astigmatismo corneal total.
CÁLCULO DEL PODER DEL IOL EN POST CIRUGÍA REFRACTIVA:
Kang y cols estudiaron pacientes post refractiva y comparaban los resultados entre el calculador de la ASCRS con los métodos convencionales (con datos pre cirugía y sin datos pre cirugía) y encontró que: cuando se disponía de los datos de la cirugía pre-refractiva, el método de Jarade aplicado en la fórmula de Hoffer Q tenía el error de predicción más bajo. Si los datos de cirugía pre-refractiva no estaban disponibles, el método de Seitz aplicado a la fórmula de Hoffer Q y el método Shammas con método de K única eran los más exactos. El calculador ASCRS que utilizaba la fórmula post-LASIK (Shammas-PL) de Shammas y la fórmula True K de Barrett obtuvo resultados comparables a los métodos convencionales mencionados
Helaly y cols intentaron determinar el cálculo óptimo del poder de la LIO para cirugía post-refractiva con varios queratómetros disponibles actualmente en el mercado. Utilizando los valores de K de la queratometría manual con el queratómetro KM-450 (Nidek), con el autoqueratómetro KR-8000 (Topcon) con IOLMaster y con Pentacam. El porcentaje más alto de cálculos de LIO con MAE +/- 0.5D era con la formula Shammas-PL con la doble-K (66.7%) usando el modulo EKR del Pentacam a 4 mm. Shammas-PL con Haigis /64.4) usando el modulo EKR del Pentacam a 4 mm. Cuando el Pentacam no estaba disponible, la queratometría medida con IOL Master usando Shammas-PL obtenía en un 57.8% un MAE de +/- 0.5 D.
MANEJO INTRAOPERATORIO:
Zhang y cols compararon los cálculos de la potencia de la LIO mediante el sistema preoperatorio IOLMaster o el IOLMaster preoperatorio más el sistema intraoperatorio de análisis refractivo de ondas ópticas (ORA) para la implantación de lentes monofocales y concluyeron que ORA proporcionaba resultados refractivos postoperatorios comparables a IOL-Master para pacientes que requierína un LIO monofocal.
Davidson y cols realizaron una revisión retrospectiva de 160 ojos a los que se realizó IOLMaster preoperatoria e intraoperatoria ORA para la implantación de lentes monofocales, tóricas y multifocales. El 46% de los ojos tenía la misma potencia de LIO calculada por los dos métodos y no se encontraron diferencias estadísticamente significativas en la refracción postoperatoria entre el tipo de lente o entros los grupos de pacientes. Sin embargo, la potencia de la IOL de ORA fue significativamente menor que la de los datos de IOLMaster para todos los tipos de lentes (P <0.01) y en los casos en que los biómetros calculaban diferencias de la LIO con más de 1.5D de diferencia, hubo un efecto positivo al elegir las mediciones del ORA.
Otras referencias (artículo 8)
- Savini G, Hoffer KJ, Barboni P, et al. Accuracy of optical biometry combined with Placido disc corneal topography for intraocular lens power calculation. Jhanji V, ed. PLoS ONE 2017; 12:e0172634.
- KongsapP.Comparison of a new optical biometer and a standard biometer in cataract patients. Eye and Vision 2016; 3:27.
- Jeong J, Song H, Lee JK, et al. The effect of ocular biometric factors on the & accuracy of various IOL power calculation formulas. BMC Ophthalmol 2017; 17:62
- Doshi D, Limdi P, Parekh N, Gohil N. A comparative study to assess the predictability of different IOL power calculation formulas in eyes of short and long axial length. J Clin Diagn Res 2017; 11:NC01 – NC04.
- Karabela Y, Eliacik M, Kaya F. Performance of the SRK/T formula using A- Scan ultrasound biometry after phacoemulsification in eyes with short and long axial lengths. BMC Ophthalmol 2016; 16:96.
- Zhang Y, Liang XY, Liu S, Lee JW, Bhaskar S, Lam DS. Accuracy of Intraocular Lens Power Calculation Formulas for Highly Myopic Eyes. J Ophthalmol. 2016;2016:1917268.
- Zhang B, Ma JX, Liu DY, et al. Effects of posterior corneal astigmatism on the accuracy of AcrySof toric intraocular lens astigmatism correction. Int J Ophthalmol 2016; 9:1276 – 1282.
- Rydström E, Westin O, Koskela T, Behndig A. Posterior corneal astigmatism in refractive lens exchange surgery. Acta Ophthalmol 2016; 94: 295 – 300
- Kang BS, Han JM, Oh JY, et al. Intraocular lens power calculation after refractive surgery: a comparative analysis of accuracy and predictability. Kor J Ophthalmol 2017; 31:479–488.
- Helaly HA, El-Hifnawy MA, Shaheen MS, Abou El-Kheir AF. Accuracy of corneal power measurements for intraocular lens power calculation after myopic laser in situ keratomileusis. Middle East Afr J Ophthalmol 2016; 23:122 – 128.
- Zhang Z, Thomas LW, Leu SY, et al. Refractive outcomes of intraoperative wavefront aberrometry versus optical biometry alone for intraocular lens power calculation. Indian J Ophthalmol 2017; 65:813–817.
- Davison JA, Potvin R. Preoperative measurement vs intraoperative aberrometry for the selection of intraocular lens sphere power in normal eyes. Clin Ophthalmol 2017; 11:923 – 929
Objetivo
Este artículo estudia la asociación entre la presión intraocular (PIO) y la medicación para el tratamiento de la hipertensión arterial.
Datos a destacar del artículo
Conocer la asociación entre la PIO y medicamentos cardiovasculares es de especial interés en pacientes glaucomatosos puesto que la mayoría presentan comorbilidades. La PIO sigue siendo el único factor de riesgo tratable del glaucoma. El riesgo de progresión puede aumentar hasta un 16% por un ascenso de 1mmHg. Por ello, pequeñas variaciones van a ser determinantes en su progresión.
Este es el primer estudio basado en la población con una muestra de más de diez mil pacientes.
A continuación veremos los resultados de dos grupos de tratamiento.
β-Bloqueantes
Su efecto sobre la PIO ha sido muy discutido. Varios estudios han encontrado una asociación entre β-Bloqueantes sistémicos y cifras de PIO bajas [Phillips et al] Sin embargo, se carece de evidencia en cuánto al efecto de dicha medicación sobre la PIO. También existe controversia sobre el hecho de que estos medicamentos tengan un efecto sinérgico hipotensor cuando se usan conjuntamente con β-Bloqueantes tópicos. Wettrel et al. describió que el efecto hipotensor de los β-Bloqueantes es independiente de si el β-Bloqueante es o no selectivo. Ninguno de los estudios previos tuvo una duración mayor a una semana.
A diferencia del tratamiento sistémico, los β-Bloqueantes tópicos han demostrado efecto hipotensor a muy corto, corto y largo plazo (Van der Valk et al.), aunque su efecto se va deteriorando a lo largo del tiempo adquiriendo una tolerancia (“drifting”) a largo plazo. Esto puede ser debido a un posible mecanismo de saturación de los receptores en la membrana celular.
Los resultados de este estudio no encontraron asociación entre β-Bloqueantes sistémicos y cifras de PIO más bajas en pacientes no glaucomatosos. Es cierto que existe una ligera tendencia de cifras levemente más bajas (-0,70 mmHg) en pacientes que usan β-Bloqueantes no selectivos, pero los resultados no son estadísticamente significativos. Es probable que comparta mecanismos adaptativos de tolerancia similares al tratamiento tópico, ya que esto explicaría el hecho de que su efecto a largo plazo es bastante menor que a corto plazo.
Los β-Bloqueantes selectivos actúan sobre los receptores β1 y los no selectivos indistintamente sobre β1/ β2. La composición de los receptores β en los cuerpos ciliares es de 90% β2 y 10% β1. Por ello se piensa que los β-Bloqueantes no selectivos tienen mayor potencia hipotensora.
Este estudio tampoco encontró ningún efecto sinérgico para la reducción de la PIO entre timolol sistémico y tópico, a diferencia de otros estudios. [Marén et al.] Estos resultados indican que se precisa más estudios al respecto y apunta posibles factores de confusión como el grosor corneal (GC), índice de masa corporal (IMC) y la tensión arterial (TA).
Inhibidores de la enzima convertidora de la angiotensina (IECAs)
Se encontró una asociación positiva entre los IECAs y la PIO teniendo en cuenta la edad y el sexo como posibles factores de confusión. El efecto se vio reducido al incluir el IMC y el GC en la fórmula de regresión. En el análisis de subgrupos, se identificó el IMC como el factor más influyente en la asociación entre la PIO y los IECAs. Esto podría indicar que los participantes que tomaban IECAs podrían sufrir de enfermedades cardiovasculares más severas como la diabetes o síndrome metabólico. Por ello, puede que estas enfermedades sistémicas tengan más influencia sobre la PIO que los IECAs.
Aunque no se incluyeron pacientes diagnosticados con glaucoma, se podría pensar que dichos resultados no son inducibles a este grupo. Aun así, la farmacodinámica de estos medicamentos no está limitada a pacientes enfermos y por ello se piensa que es razonable el estudio en pacientes sanos.
Como principal limitación del estudio, sólo se midió la PIO en una ocasión, no teniendo en cuenta las fluctuaciones diurnas de la PIO.
Conclusión
Los β-Bloqueantes sistémicos y IECAS no han demostrado disminuir la PIO en pacientes glaucomatosos en un estudio poblacional con una muestra grande. No obstante, sólo un ensayo clínico determinará la relación de causalidad entre los β-Bloqueantes y su efecto sobre la PIO.
Otras referencias recomendadas (artículo 9)
- Marén N, Alvan G, Calissendorff BM, et al. Additive intraocular pressure reducing effect of topical timolol during systemic beta-blockade. Acta Ophthalmol 1982;60:16–23.
- Höhn R, Kottler U, Peto T, et al. The ophthalmic branch of the Gutenberg health Study: study design, cohort profile and self-reported diseases. PLoS One2015;10:e012047
- Cheong KC, Ghazali SM, Hock LK, et al. The discriminative ability of waist circumference, body mass index and waist-to-hip ratio in identifying metabolic syndrome: variations by age, sex and race. Diabetes Metab Syndr 2015;9:74–8.
- Van der Valk R, Webers CA, Schouten JS, et al. Intraocular pressure-lowering effects of all commonly used glaucoma drugs: a meta-analysis of randomized clinical trials. Ophthalmology 2005;112:1177–85.
Objetivo
Reportar seis casos de infección corneal relacionadas con el uso lentes de contacto en horas nocturnas.
DATOS A DESTACAR DEL ARTÍCULO
Entre los muchos comportamientos que aumentan el riesgo de una infección corneal relacionada con lentes de contacto, dormir con lentillas es uno de los más destacados, siendo uno de los más comunes entre los usuarios adolescentes y adultos jóvenes (Cope JR). Hasta un tercio de los usuarios de lentillas confiesan haber dormido por la noche o la siesta con las lentillas. Dormir en lentillas, ya sea inadvertidamente, ocasionalmente o como parte de una prescripción (es decir, lentes de uso prolongado), aumenta el riesgo de infecciones oculares relacionadas con lentes de contacto de seis a ocho veces (Dart).
Caso 1:
Paciente de 34 años que confesó que durante 17 años usaba lentes de contacto blandas y que dormía 3-4 veces/semana con las lentillas y que nadaba con ellas. Diagnóstico: queratitis por Acanthamoeba
Caso 2:
Paciente de 59 años que tras dormir con las lentillas puestas durante dos días. Diagnóstico: una úlcera corneal que finalmente acabó perforándose y necesitó un trasplante corneal.
Caso 3:
Paciente de 34 años que reconocía dormir rutinariamente con las lentillas y usarlas durante más tiempo del recomendado para el reemplazo mensual. Compraba las lentillas a una minorista a través de internet. Diagnóstico: úlcera de hipopion
Caso 4:
Paciente de 57 años que renoció el uso ininterrumpido de sus lentillas durante dos semanas. Diagnóstico: quratitis bacteriana bilateral, ojo derecho con una úlcera infiltrada y perforada que necesitó un trasplante corneal y en el ojo izquierdo con una úlcera infiltrada con hipopion.
Caso 5:
Paciente de 17 años reconoció el uso de lentillas de contacto blandas que no se quitaba para dormir. Compraba las lentillas sin receta. Diagnóstico: úlcera infiltrada por Pseudomona aeruginosa que dejó una cicatriz estromal con un adelgazamiento.
Caso 6:
Paciente de 18 años que reconoció que dormía con sus lentes de contacto blandas y ‘’decorativas’’ obtenidas en una tienda sin licencia. Diagnóstico queratitis bilateral por Klebsiella pneumoniae y Pseudomona aeruginosa que terminó en una cicatriz estromal.
CONCLUSIÓN
Se ha demostrado que dormir en las lentes es un factor de riesgo independientemente del material y la frecuencia de la lente, ya que incluso el uso nocturno ocasional conlleva un riesgo (Stapleton y Sauer). Las medidas de educación para la salud dirigidas a quienes usan lentes de contacto deben enfatizar la conciencización sobre los riesgos de dormir con lentes de contacto, así como el cumplimiento de todas las recomendaciones para el uso y cuidado de las mismas.
Otras referencias recomendadas (artículo 10):
- -Cope JR, Collier SA, Nethercut H, Jones JM, Yates K, Yoder JS. Risk behaviors for contact lens–related eye infections among adults and adolescents—United States, 2016. MMWR Morb Mortal Wkly Rep 2017;66:841–5.
- -Dart JK, Radford CF, Minassian D, Verma S, Stapleton F. Risk factors for microbial keratitis with contemporary contact lenses: a case-control study. Ophthalmology 2008;115:1647–54.e3
- -Stapleton F, Edwards K, Keay L, et al. Risk factors for moderate and severe microbial keratitis in daily wear contact lens users. Opthalmology 2012;119:1516–21.
- -Sauer A, Meyer N, Bourcier T; French Study Group for Contact Lens–Related Microbial Keratitis. Risk factors for contact lens-related microbial keratitis: a case-control multicenter study. Eye Contact Lens 2016;42:158–62.
AUTORES

Carlos Rocha de Lossada
– Hospital Regional Universitario de Málaga

Rahul Rachwani Anil
– Hospital Regional Universitario de Málaga