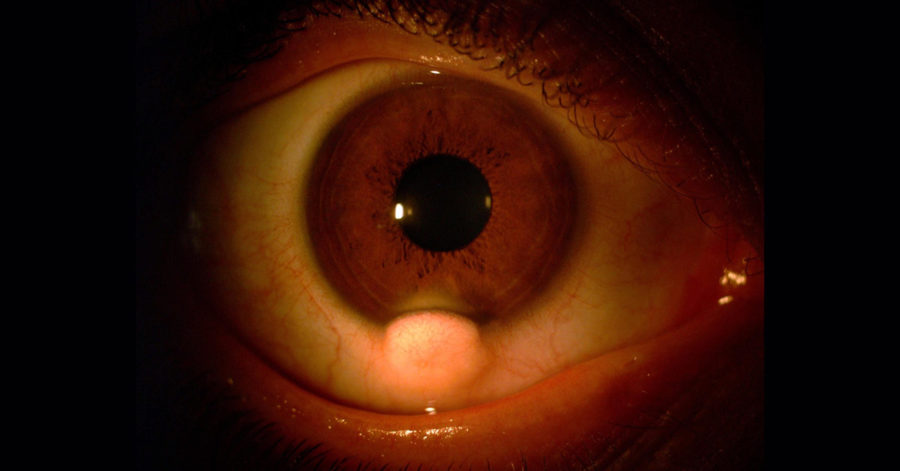
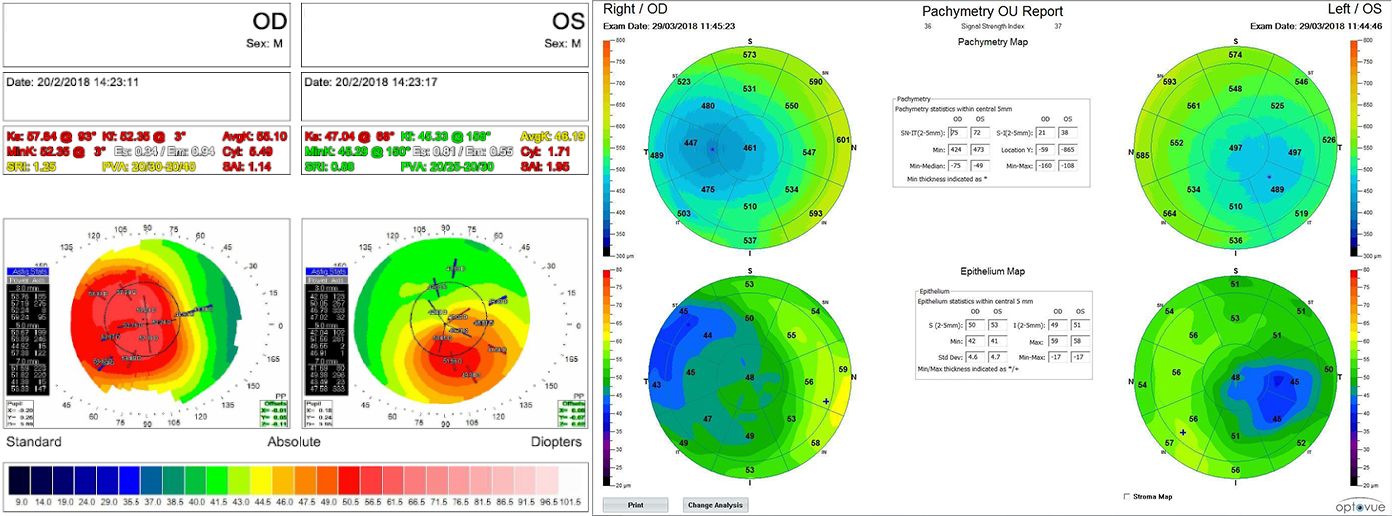
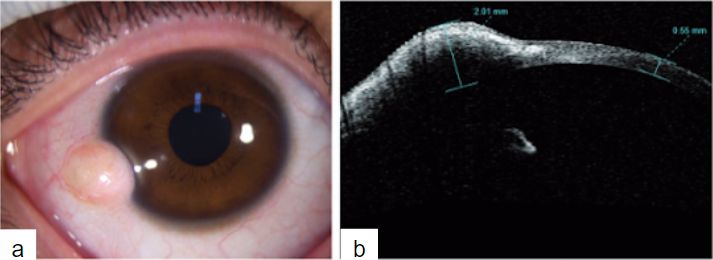
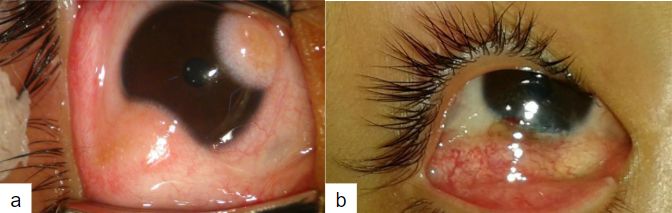
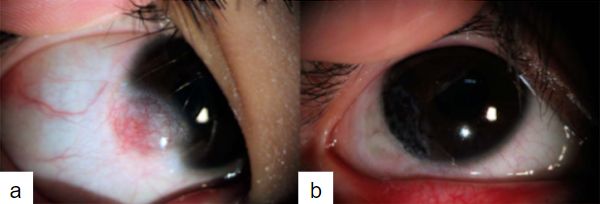
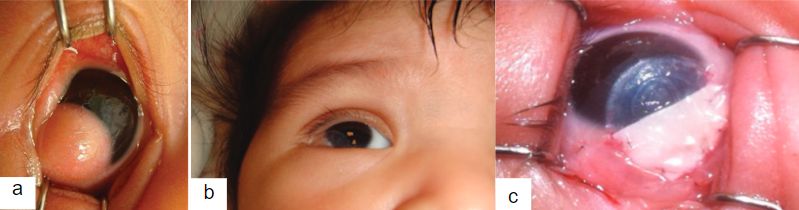
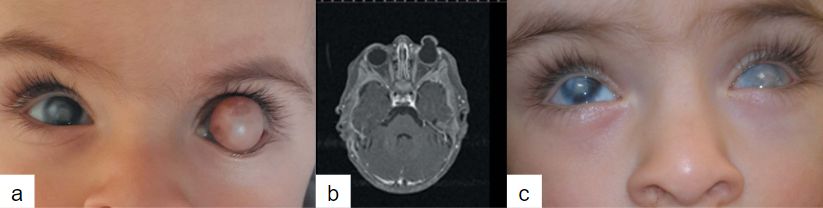
De esta manera se iniciaba un nuevo Hilo en el Foro FacoElche. El Dr Hugo Scarfone y la Dra Carolina Le Bras presentaron el caso de un paciente de 31 años con un quiste dermoide limbar inferior (Imagen 1a e Imagen 1b) en el ojo derecho (OD) asociado a queratocono en ambos ojos (AO) (Imagen 2).
Como antecedentes personales presentaba apéndices preauriculares homolaterales a la lesión, que fueron extirpados previamente.
La agudeza visual del paciente, estable desde hace unos años, era 20/40 en OD con una refracción de esf -8.00 cil -5.00 (no menciona el eje) y en OI 20/20 con esf -1.00 cil -0.50 (no menciona el eje).
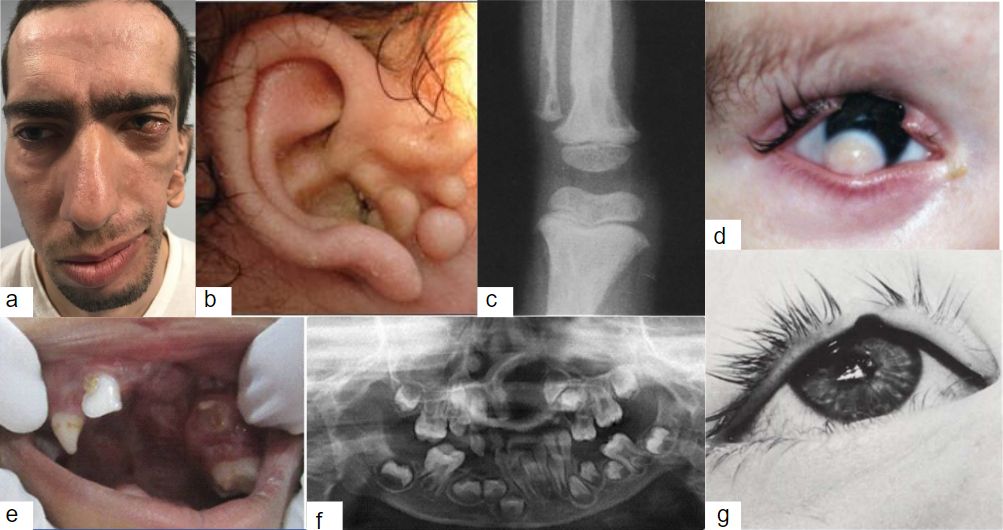
El síndrome de Goldenhar (SG) o de Goldenhar-Gorlin, conocido igualmente como displasia oculo-aurículo-vertebral o displasia facio-auriculo-vertebral, es una enfermedad congénita rara, generalmente esporádica aunque puede ser autosómica dominante, con una incidencia estimada de 1:3500-1:5600 y con una relación hombre/mujer de 3:2(1,2 ,3). Fue descrita por primera vez por el Dr Maurice Goldenhar en 1952 y se produce por una alteración en el desarrollo del primer y segundo arco branquial, parece ser que por factores nutricionales y/o medioambientales.
Se caracteriza por una alteración en el desarrollo de diversas estructuras corporales, como los ojos, las orejas (pudiendo incluso afectar a la audición), labios, lengua, paladar, mandíbula, maxilar y una deformación de estructuras dentarias. Todas estas estructuras derivan del primer y segundo arco branquial(3).
Manifestaciones Clínicas
El diagnóstico del SG es básicamente clínico. Se manifiesta clásicamente por una tríada caracterizada por hipoplasia mandibular, malformación ocular y anomalía vertebral(1).
También se observan alteraciones en órganos internos como el corazón, riñón, sistema nervioso central y a nivel óseo con defectos vertebrales. La gravedad del SG varía desde leve a severa(3).
Otras alteraciones asociadas frecuentemente son anormalidades auriculares, característicamente apéndices auriculares y/o fístulas preauriculares, e hipoplasia de los huesos malar, maxilar y del arco cigomático. En los niños se puede observar además bajo peso al nacer, retraso del desarrollo psicomotor, retraso mental, problemas en el habla, problemas psico-sociales y comportamiento autista(3). (Imagen 3)
Alteraciones oftalmológicas
Dentro de las alteraciones oftalmológicas, en el SG se han descrito: coristoma epibulbar (lesión ocular característica en el SG), coloboma de párpado (característicamente del párpado superior) y ceja, alteraciones del drenaje lagrimal, síndrome de Duane, oftalmoplejia (frecuentemente del tercer par craneal), microftalmos, queratitis neuroparalítica, dermolipoma orbitario, neuropatía facial, criptoftalmos parcial, coristoma de párpados, heterocromía de iris, aniridia, coloboma uveal, catarata, hipoplasia del nervio óptico, pseudopapiledema, hipopigmentación peripapilar y tortuosidad vascular de la retina(1, 4).
Centrándonos específicamente en la clínica del paciente comentado en el foro vamos a describir ampliamente la lesión.
Dermoides oculares
Los dermoides son parte de un grupo de lesiones conocidas como coristomas que se caracterizan por ser un sobrecrecimiento congénito benigno de un tejido normal que se encuentra en localización anormal. Crecen generalmente en la pubertad y se cubren de pelos. En los coristomas se pueden encontrar diversos tejidos: apéndices epidermales, tejido adiposo, músculo liso, estriado, de glándula lagrimal, cartílago, hueso, dientes, tejido nervioso y tejido linfoide. Los coristomas oculares se encuentran frecuentemente en la región epibulbar, los párpados y la coroides.
Histológicamente se pueden dividir en cuatro tipos: dermolipoma, dermoide, coristoma simple y coristoma complejo(4).
La herencia de los coristomas es variable. Pueden ser autosómicos dominantes, recesivos, ligados al cromosoma X o multifactoriales(4). Son lesiones generalmente benignas siendo la malignización infrecuente(4).
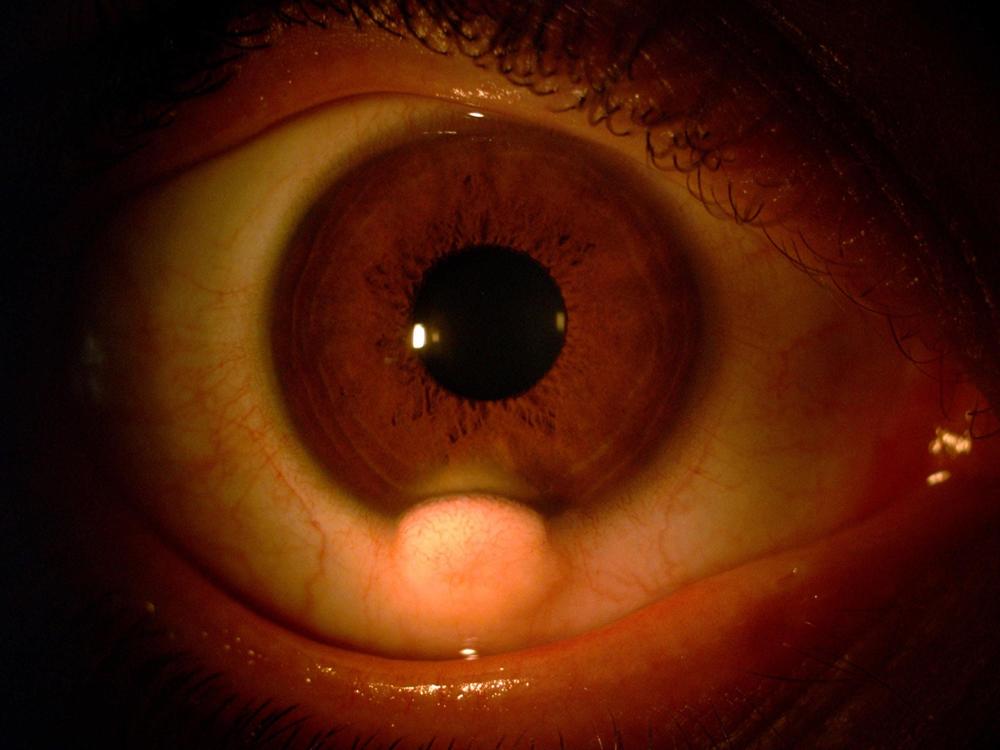
Clínicamente los coristomas epibulbares son tumores sólidos que pueden tener la superficie suave o áspera pudiendo ser duros o de consistencia gomosa o suave, de color claro entre blanco, gris, rosado, amarronado y amarillento. En cuanto al tamaño pueden ser planos y de pocos milímetros, hasta grandes masas que abarquen parte del limbo, córnea o áreas subconjuntivales afectando a la agudeza visual y provocando astigmatismo. Las lesiones pueden ser uni o bilaterales(6) y puede existir más de una lesión en el mismo ojo.
Ash y cols. en 1950 con 82 casos, determinaron que el 53% de los coristomas epibulbares se localizan en la conjuntiva bulbar, el 29% en el limbo, 6% en la córnea, 4% en la carúncula y 2.5% en fórnix y conjuntiva palpebral. En cuanto a la localización, el 94% son temporales, y 83% inferiores(4).
Una vez que se diagnostica clínicamente la lesión, es imprescindible estudiarla en profundidad para poder tomar una decisión en el tratamiento.
Técnicas diagnósticas
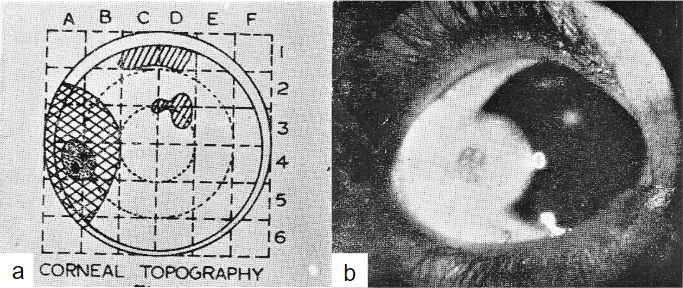
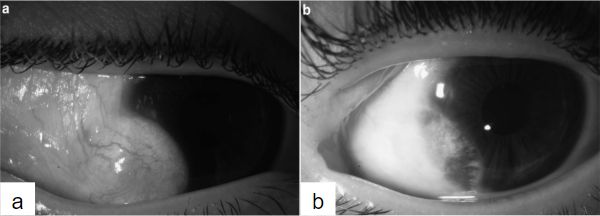
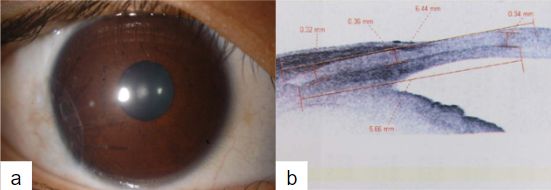
Antes de los años 90, y del desarrollo de la tecnología en imágenes, la documentación se realizaba a partir de dibujos topográficos (Imagen 4.a) o documentación fotográfica (Imagen 4.b), asociados a la evaluación de la cámara anterior con gonioscopia(7).
En 1990 con el desarrollo de la biomicroscopía ultrasónica(BMU) pudo lograrse evaluar la profundidad de los dermoides corneo-conjuntivales. Se pudo determinar que afectan a la conjuntiva y a las capas superficiales de la córnea, no afectando generalmente a todo el espesor corneal. La BMU utiliza sondas de 50 a 100 mHz que permiten evaluar los tejidos superficiales con muy alta resolución. Así mismo evalúa la densidad, la extensión en profundidad y la afección de las estructuras vecinas, siendo una herramienta útil para el cálculo preoperatorio del plano quirúrgico necesario para la extirpación de la misma. (Imagen 5)(8). Muestra a los dermoides como lesiones hiperreflectivas en relación a la córnea subyacente con lo cual es sencilla su delimitación para definir la extensión previa a la cirugía tanto en superficie como en profundidad, sabiendo que los márgenes laterales son más sencillos de identificar que los profundos debido a la atenuación del sonido intralesional(9).
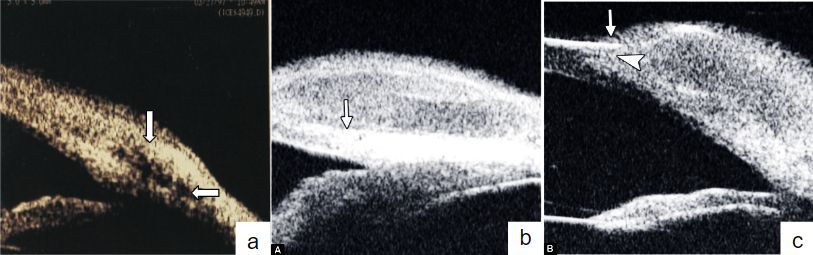
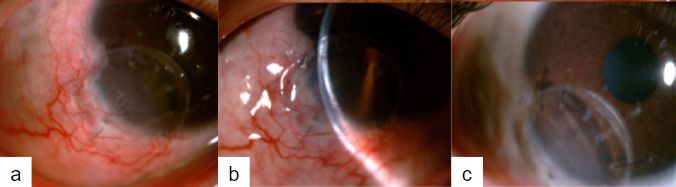
En 1991 se comenzó a utilizar la tomografía de coherencia óptica (OCT) para evaluar el polo posterior y hacia el año 2001 se describió la técnica modificada para el estudio del segmento anterior(11). (Imagen 6)
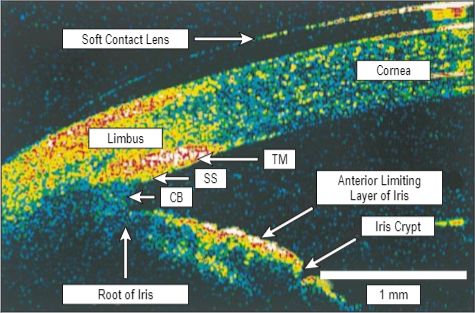
La OCT de segmento anterior trae como ventajas que es una técnica de no contacto y que permite evaluar imágenes transversales del segmento anterior. Es ampliamente utilizada para estudiar procesos patológicos del segmento anterior como tumores (ejemplo en la neoplasia escamosa córneo-conjuntival) o en inflamaciones y es especialmente útil en la evaluación de la configuración de la cámara anterior(12). (Imagen 7)
La OCT ha mejorado la calidad y resolución de imágenes con el paso de los años. Los equipos que utilizan longitud de onda más larga generan menor dispersión de la luz y tienen penetración más profunda para las estructuras opacas, incluso la esclera.
La OCT sirve para evaluar el plano en el cual una lesión se encuentra unida a la córnea(14).
La gran diferencia entre UBM y OCT es que la UBM puede penetrar los tejidos pigmentados u opacos de manera completa mientras que las imágenes de OCT se hacen más difusas e imprecisas en las partes profundas de los mismos(12).
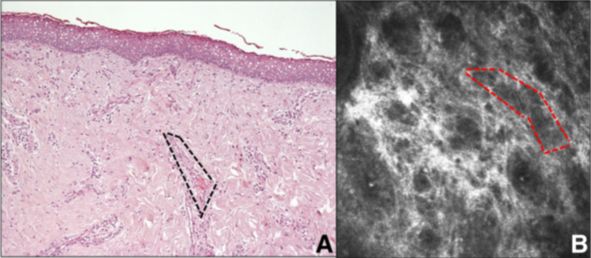
En el año 2013 se describió la utilidad de la microscopia confocal in vivo para caracterizar histológicamente los dermoides previo a la cirugía y la posibilidad de utilizarla como elemento predictor en la evolución de la lesión(15). (Imagen 8)
Clasificaciones
Una clasificación antigua pero aún vigente, toma en consideración la profundidad de la afección corneal y las malformaciones(16). En esta se describen, el grado I en el que se incluyen lesiones corneales superficiales menores a 5 mm, en el grado II lesiones más profundas que dejan intacta la membrana de Descemet y el endotelio simulando un estafiloma o esclerocórnea. Por último, las alteraciones que afectan al segmento anterior y que se acompañan de malformaciones como microftalmos, serían consideradas como Grado III.
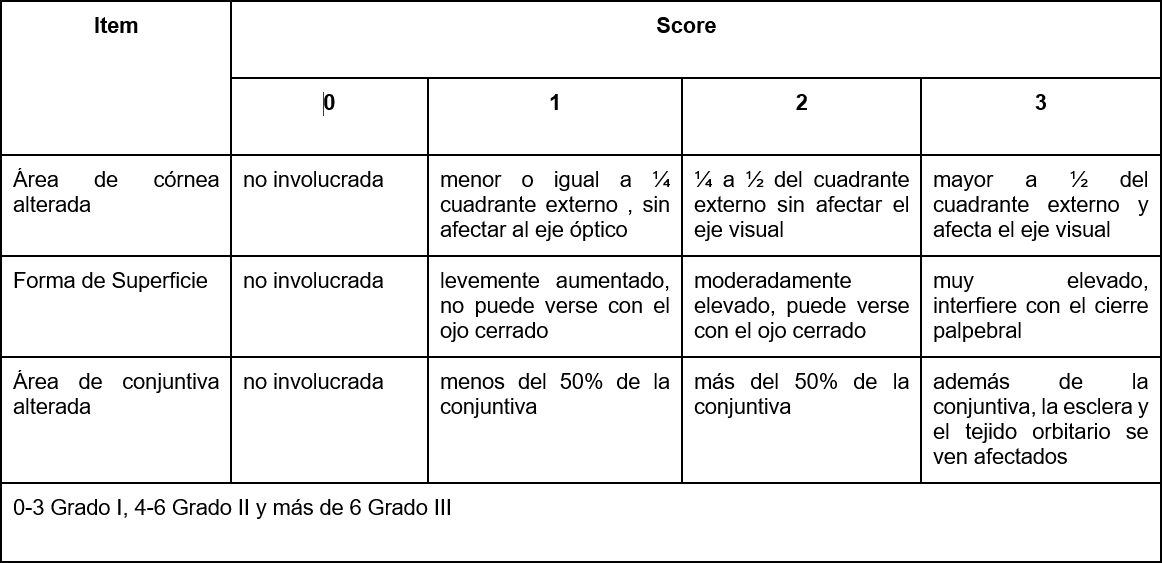
En el año 2018 Zhong y cols. publicaron una nueva clasificación para los dermoides limbares dónde se evalúa el área de córnea alterada, la forma de la superficie y el área de conjuntiva afectada indicando en cada caso un score de 0 a 3(17). (Tabla 1 y Imagen 9)
Se clasifican en grados 1, 2 y 3 según la cantidad de puntos. Esta nueva escala es útil a la hora de proponer un tratamiento y evaluar su pronóstico(17).
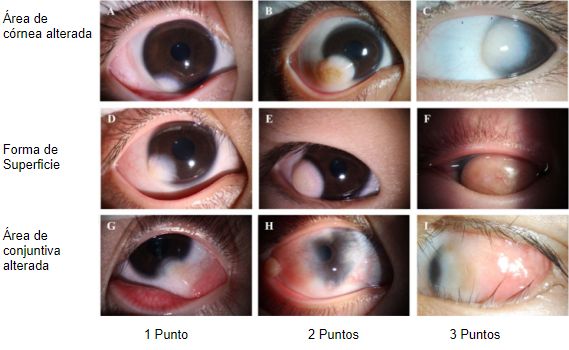
En el Grado 1 debido a que no hay afección del eje visual y dada la baja posibilidad de ambliopía, se recomienda queratoplastia lamelar (QPL) para mayores de 3 años(17). En el Grado 2 se propone queratoplastia lamelar o queratoplastia lamelar profunda y debe abordarse tempranamente ya que los dermoides avanzados pueden producir astigmatismos mayores, comprometiendo el desarrollo visual. Para el Grado 3 ante el astigmatismo elevado, el compromiso del eje visual y el riesgo de ambliopía se proponen la queratoplastia anterior lamelar profunda (DALK) o queratoplastia penetrante (QP).
Opciones de tratamiento planteadas en el foro
El Dr. Christian Fau propone solamente resección, a la que el Dr. Ricardo Galue le agregaría un recubrimiento con membrana amniótica (MA). El Dr José A. Gegúndez propone agregar la queratoplastia lamelar tectónica y un parche de MA. El Dr. Luis Izquierdo le agrega a la resección simple un recubrimiento conjuntival.
El Dr Juan Álvarez de Toledo propone resección laminar profunda con trépano y disección lamelar, injerto corneal lamelar y recubrimiento con colgajo conjuntival o membrana amniótica si fuese necesario.
Elección de tratamiento según Graduación de Mann
El quiste dermoide puede ser manejado de manera médica o quirúrgica(18). Se sabe que el astigmatismo corneal continúa progresando, se realice o no intervención quirúrgica, debido a los cambios que se producen por el crecimiento normal de cada persona(19). Si el paciente fuese a someterse a una extirpación de las lesiones preauriculares asociadas, puede plantearse durante el mismo acto quirúrgico la resección simultánea del dermoide ocular(19).
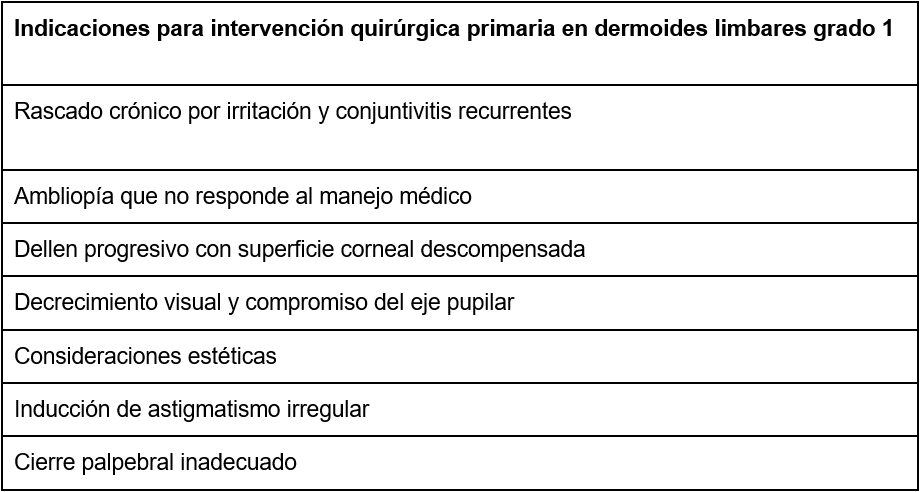
Los quistes Grado I, que generan astigmatismo menor a 1.00 D, y en los cuales los padres colaboran con el uso de gafas, generalmente se aconseja la observación ya que la cirugía puede generar cicatrices y pseudopterigion en el postoperatorio. Se deben realizar controles cada 2 o 3 meses con toma de AV y medición del tamaño de la lesión con fotografía digital(18) cuando sea posible. En el caso de que en los sucesivos exámenes aparezca una marcada anisometropía, ambliopía o los padres no colaboren con el uso de gafas y oclusión, o en aquellos que presenten problemas de la superficie ocular, se plantea la posibilidad de extirpación quirúrgica siempre explicando la posibilidad del desarrollo de cicatriz en el sitio de la lesión.
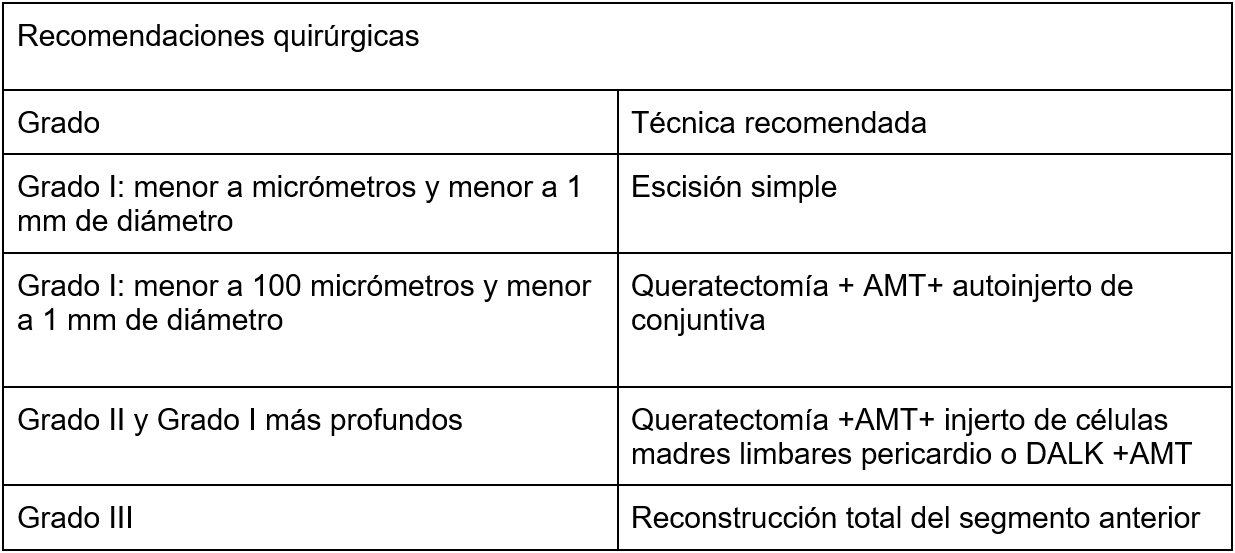
Las indicaciones quirúrgicas para el Grado I son las propuestas en la Tabla 2.(20)
En los Grado II y III independientemente de las alteraciones estéticas la cirugía se indica cuando el crecimiento de las lesiones es persistente, la AV disminuye, el astigmatismo es elevado y hay ambliopía, ya que estos factores asociados afectan negativamente el desarrollo visual(21).
El tiempo para la escisión varía dependiendo del tamaño de la lesión al nacer, la tasa de crecimiento, y las áreas anatómicas que compromete. También es importante la solicitud de la familia para removerlo debido a cuestiones psicosociales(20).
Técnicas quirúrgicas
Existen variadas opciones para reconstruir el área donde se realiza la resección de la lesión. Las técnicas propuestas varían desde la escisión simple, pasando por técnicas lamelares más o menos complejas, hasta técnicas penetrantes.
Escisión simple
Se realiza una peritomía conjuntival alrededor de la lesión y luego se procede a la resección de la misma con un cuchillete recto o biselado. Luego la disección comienza en el borde escleral del quiste hacia la córnea en un solo plano. Se utiliza esta técnica asociada a la disección (no al corte del tejido), traccionando del quiste hacia arriba.
La resección a ⅔ de profundidad es suficiente para remover el dermoide completamente. Si el defecto que se deja en la conjuntiva es amplio, se moviliza la conjuntiva circundante con ayuda de disección roma y se fija utilizando suturas reabsorbibles o adhesivo tisular(22).
Algunos estudios muestran que la escisión simple, sin y con escleroqueratoplastia son técnicas efectivas para el manejo de quistes dermoides limbares grados I y II(23).
La escisión simple para grados I y II podría traer ciertas complicaciones como problemas de estabilidad, defectos epiteliales persistentes, vascularización y/o formación de pseudopterigion(24).
Escisión e injerto de células madre
La escisión simple puede acompañarse de injerto conjuntival y de células madre limbares. Esta técnica mejora la transparencia corneal y la resolución del defecto epitelial en comparación con la escisión simple(25).(Imagen 10)
Escisión y tatuaje corneal
La técnica de escisión simple puede asociarse a tatuaje corneal y autoinjerto de conjuntiva con buenos resultados en quistes grado I. Con esta técnica proponen resolver la cicatriz corneal que deja el quiste y además al utilizar adhesivo tisular se acortan los tiempos quirúrgicos y se reducen las molestias que producen las suturas. Al remover el quiste se elimina parte del limbo, por lo que el autoinjerto de limbo conjuntival proporciona células limbares previniendo la conjuntivalización posterior(26).
Las técnicas de tatuaje son múltiples, dentro de ellas tenemos la punción de estroma anterior, que presenta el riesgo de perforación por utilizar para su realización elementos que no están calibrados y además de la dificultad de estimar el lecho residual; tatuaje superficial luego de desbridar el epitelio (es una técnica mínimamente invasiva y en el caso del dermoide se aplica luego de su remoción); o tatuaje estromal luego de crear un flap con microquerátomo o femtosegundo.
Todo paciente en el que vaya a aplicarse este procedimiento asociado a tatuaje corneal, debe ser debidamente asesorado dadas las expectativas cosméticas y los resultados esperados. Los pigmentos son múltiples y deben elegirse de acuerdo a la pigmentación del iris del paciente.
Adición de membrana amniótica
Dados los múltiples usos de la MA se propone una técnica de multicapa con adhesivo tisular.
Luego de realizar la peritomía, la disección lamelar y con la remoción de la lesión, se trata la superficie con un torno para eliminar imperfecciones.
Al tomar la MA, se pliega y posteriormente se corta para que tome la forma del defecto generado luego de la remoción de la lesión. Se utiliza adhesivo tisular para pegar las capas de MA en el defecto y luego se aplica una monocapa de MA por encima para cubrir un área mayor y así fijar las estructuras por debajo. Se recomienda fijar la MA con puntos separados 10-0 para prevenir que el parche de MA se disloque(20).
Otra variable que se describió en 2014 es la asociación de escisión simple y Mitomicina C (MMC) a la cirugía(21), tal y como comentaba el Dr. Javier Rodríguez.
Lang y cols. proponen la remoción lamelar de la lesión utilizando MMC 0.02% durante 2 minutos sobre la esclera descubierta. Dentro de este estudio se compara este grupo contra otro en el cual se realizó la remoción simple sin y con la aplicación de MA. Se determinó que los pacientes a los cuales se les aplicó MMC no tuvieron complicaciones, pero no se obtuvieron diferencias entre los grupos en la agudeza visual final(21). (Imagen 12)
En un estudio más reciente Cho y cols. proponen la asociación de escisión simple, aplicación de MMC y luego la colocación de una monocapa de MA(21, 27).
Escleroqueratoplastia lamelar
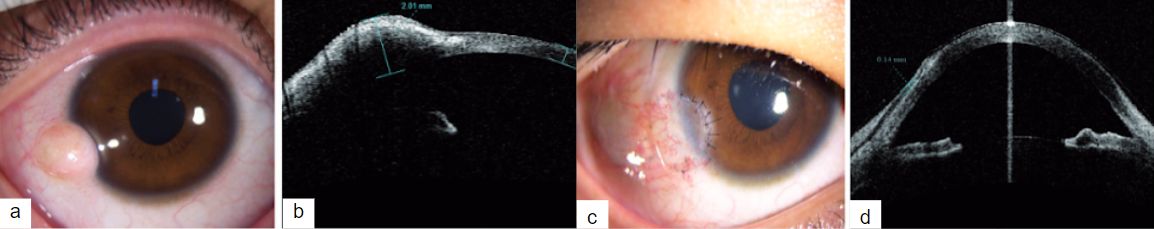
La técnica lamelar se realiza con la trepanación manual de al menos la mitad del tejido que contiene la lesión, y se realiza la disección manual del tejido esclerocorneal en la profundidad de la trepanación. El tejido donante debe ser ¼ mm mayor en diámetro y se debe orientar en el lecho receptor y suturar con 8 puntos separados con nylon 10-0 y deben enterrarse los nudos. La conjuntiva se sutura en su sitio anatómico, en el limbo esclerocorneal(28). (Imagen 13)
Queratoplastia Lamelar
En algunos estudios la técnica se describe con la colocación de un injerto corneal central, incluso con córneas criopreservadas(29).
En este las células endoteliales con una esponja seca de celulosa y se sutura con puntos separados de Nylon 10-0 del lado corneal y 9-0 del lado escleral (Imagen 14)(24).
Parche corneal de remanente corneal post DSAEK
En el año 2017 Wu y cols. Proponen la utilización del tejido corneal remanente utilizado para DSAEK, como parche corneal. En este estudio se operaron 8 pacientes con mejoras en el astigmatismo y solamente 3 mejoraron la agudeza visual. La técnica fue utilizada para dermoides grado II. Esta es la técnica que propone en nuestro foro el Dr. Federico Cremona.
La técnica describe que el tejido donante se corta con una cámara artificial en dos partes: una anterior de alrededor de 350 micras y otro posterior de 120 a 180 micras. Esta técnica sería importante proponerla en aquellos países en los cuales el boton esclerocorneal puede ser solamente utilizado para un paciente ya que la técnica no es nueva, pero ayuda al problema global de la falta de córneas donantes utilizando un tejido para 2 pacientes. Además conociendo que la disección manual puede producir imperfecciones cuando el dermoide no afecta el espesor corneal completo(30). (Imagen 15 e Imagen 16)
Parche corneal post SMILE
Una novedosa técnica consiste en remover el dermoide grado I y luego de aplicar pigmento (tatuaje corneal), se adhiere con adhesivo tisular un lentículo de estroma corneal obtenido de una cirugía Small Incision Lenticule Extraction (SMILE) de un paciente sano (previamente en el donante se descartaron enfermedades infecciosas como HIV, HBV, HCV y enfermedades de transmisión sexual). En esta técnica se sugiere la posible adición de una monocapa de MA para modular la cicatrización a nivel conjuntival. La limitación es que solamente se podría realizar en países donde se realiza SMILE, aunque podría encargarse al banco de tejidos(31).
En ausencia de adhesivo tisular, en quistes dermoides grado I, el lentículo estromal se puede suturar con nylon 10.0 y sin la asociación de pigmento corneal(31). (Imagen 17)
Parche de pericardio
En aquellos casos en los que se requiera tejido para reconstruir la esclera debilitada, se puede utilizar pericardio de 400 micrones que es comparable con el parche de tejido escleral(32). (Imagen 18)
Autoinjerto de Esclera
Existe una propuesta para los grado III en la cual la reconstrucción parcial de la córnea se realizó con un autoinjerto de esclera obtenido de la esclera temporal superior, con posibilidad de realizar a posteriori técnicas para la mejora estética(33).
La técnica quirúrgica descrita consiste en la realización de una peritomia 360 grados y disección cautelosa de la conjuntiva de ese ojo. Recomiendan que el tejido escleral obtenido sea 1 mm mayor que el diámetro de la lesión para maximizar la correcta aposición de los tejidos. El botón escleral se sutura con vicryl 7-0.
Luego se cubre con un flap conjuntival obtenido desde la conjuntiva nasal y suturando a la esclera con vicryl 8-0(33). (Imagen 19)
Técnicas más complejas
Para el Grado III se propone la reconstrucción del segmento anterior. Existen diversas técnicas según la complejidad de la lesión y las lesiones asociadas.
Puede realizarse queratoplastia penetrante con o sin lensectomía asociada, enucleación(34) o evisceración cuando el quiste grado III se asocia a microftalmos, queratoprótesis si se asocia a estafiloma(18, 34).
Complicaciones
Las complicaciones varían según las técnicas utilizadas.
La escisión simple puede generar defectos epiteliales persistentes,vascularización corneal y opacificación(18).
El uso de MMC puede asociarse a la aparición de isquemia temporaria que resuelve sin mayores complicaciones(21).
La combinación de escisión simple asociada a tatuaje corneal puede producir déficit de células madre limbares (LSCD) y asociarse a la aparición de defectos epiteliales y vascularización corneal periférica(26), opacidad corneal y pseudopterigion(35).
Las complicaciones asociadas al tatuaje corneal son variadas dependiendo de las técnicas y dentro de éstas podemos encontrar infecciones, reacción tóxica severa, melting corneal, queratitis granulomatosa, erosiones corneales o defectos epiteliales persistentes, iridociclitis, dolor, riesgo de penetración inadvertida en la cámara anterior, sensibilidad a la luz, desvanecimiento del color, quiste de la cápsula de tenon y neovascularización(36, 37).
La colocación y fijación de MA con adhesivo tisular posterior a la escisión del quiste puede asociarse a la pérdida de la misma, pero esta complicación se logra evitar colocando suturas para la fijación de la misma(20). Por otro lado el uso de adhesivo tisular puede aumentar el costo de la cirugía(38).
En la escleroqueratoplastia lamelar con injerto corneal central del donante se vio opacidad corneal y tono azulado en la esclera. reepitelización prolongada, neovascularización de la interfase, rechazo y glaucoma inducido por los corticoides(18, 24, 39).
En la queratoplastia lamelar siempre existe la posibilidad de rechazo, infección, astigmatismo inducido por la cirugía y las complicaciones a largo plazo por el uso prolongado de corticoides o agentes inmunosupresores(35, 40).
También existe la posibilidad de microperforación que puede culminar con un trasplante penetrante(40).
La queratoplastia lamelar con injerto de lamela estromal obtenida de la realización de SMILE asociada a fijación con adhesivo tisular (fibrina) incluye la dehiscencia del injerto y la pérdida del mismo que se minimizan con la aplicación de suturas con nylon 10-0(13).
El manejo quirúrgico asociado a la utilización de lamelas obtenidas de la realización de DSAEK se vio asociado a la aparición de inyección conjuntival, neovascularización de la interfase y edema estromal(30).
Conclusión
Los quistes dermoides asociados al SG son una patología poco frecuente. Hoy en día no existe un consenso generalizado para la indicación de tratamiento. Existen múltiples técnicas quirúrgicas para su resolución que van a depender no solo de la clínica del paciente y su estadificación, si no de la técnica que domine el cirujano y de los elementos y tejidos disponibles para la realización de la misma.
En algunos casos de bajo grado se puede realizar el seguimiento de la lesión solamente con observación y manejo médico. En casos más avanzados es preferible la cirugía temprana para evitar la ambliopía. En la tabla 3 Pirouzian resume las diferentes técnicas indicadas según el grado de la lesión.
Referencias
- S. Schmitzer, M. Burcel, D. Dăscălescu, and I. C. Popteanu, “Goldenhar Syndrome – ophthalmologist’s perspective,” Rom. J. Ophthalmol., vol. 61, no. 2, pp. 96–104, Jun. 2018.
- A. Luiz et al., “Goldenhar’s Syndrome-Case Report,” Braz Dent J, vol. 14, no. 1, pp. 67–70, 2003
- K. Bogusiak, A. Puch, and P. Arkuszewski, “Goldenhar syndrome: current perspectives,” World Journal of Pediatrics, vol. 13, no. 5. Institute of Pediatrics of Zhejiang University, pp. 405–415, 01-Oct-2017
- M. Mansour, J. C. Barber, R. D. Reinecke, and F. M. Wang, “Ocular choristomas,” Survey of Ophthalmology, vol. 33, no. 5. pp. 339–358, 1989.
- C. Seethalakshmi Ashokan, A. Sreenivasan, and G. K. Saraswathy, “Goldenhar syndrome – Review with case series,” J. Clin. Diagnostic Res., vol. 8, no. 4, 2014.
- P. Henkind, G. Marinoff, A. Manas, and A. Friedman, “Bilateral corneal dermoids,” Am. J. Ophthalmol., vol. 76, no. 6, pp. 972–977, 1973
- A. P. Madan Mohan, G Mukherjee, “Clinical evaluation and surgical intervention of limbal dermoid,” Indian J. Ophthalmol., vol. 29, no. 2, pp. 69–73, 1989.
- Y. J. Mingguang He , Dandan Wang, “Overview of Ultrasound Biomicroscopy,” J. Curr. Glaucoma Pract., vol. 6, no. 1, pp. 25–53, 2012.
- J. P. Hoops, K. Ludwig, K. P. Boergen, and A. Kampik, “Preoperative evaluation of limbal dermoids using high-resolution biomicroscopy,” Graefe’s Arch. Clin. Exp. Ophthalmol., vol. 239, no. 6, pp. 459–461, 2001.
- M. Bhende, J. Biswas, and L. Gopal, “Ultrasound biomicroscopy in the diagnosis and management of intraocular gnathostomiasis,” Am. J. Ophthalmol., vol. 140, no. 1, pp. 140–142, Jul. 2005.
- S. Radhakrishnan et al., “Real-time optical coherence tomography of the anterior segment at 1310 nm,” Arch. Ophthalmol., vol. 119, no. 8, pp. 1179–1185, 2001.
- M. Doors, T. T. J. M. Berendschot, J. de Brabander, CAB Webers, and RMMA Nuijts, “Value of optical coherence tomography for anterior segment surgery,” Journal of Cataract and Refractive Surgery, vol. 36, no. 7. pp. 1213–1229, Jul-2010.
- P. Pant, J. L. Hao, D. D. Zhou, F. Wang, B. J. Zhang, and C. W. Lu, “Lamellar keratoplasty using femtosecond laser intrastromal lenticule for limbal dermoid: Case report and literature review,” J. Int. Med. Res., vol. 46, no. 11, pp. 4753–4759, Nov. 2018.
- M. Ang et al., “Anterior segment optical coherence tomography,” Progress in Retinal and Eye Research, vol. 66. Elsevier Ltd, pp. 132–156, 01-Sep-2018.
- G. Triolo, G. Ferrari, C. Doglioni, and P. Rama, “In vivo confocal microscopy in goldenhar syndrome: A case report,” BMC Ophthalmol., vol. 13, no. 1, 2013.
- Mann I. Developmental Abnormalities of the Eye. In: Mann I, 2nd ed. Philadelphia, PA: Lippincott; 1957.
- J. Zhong et al., “New grading system for limbal dermoid: A retrospective analysis of 261 cases over a 10-year period,” Cornea, vol. 37, no. 1, pp. 66–71, 2018.
- A. Pirouzian, “Management of pediatric corneal limbal dermoids,” Clinical Ophthalmology, vol. 7. pp. 607–614, 27-Mar-2013.
- T. Matsuo, “Clinical decision upon resection or observation of ocular surface dermoid lesions with the visual axis unaffected in pediatric patients,” Springerplus, vol. 4, no. 1, Dec. 2015.
- A. Pirouzian, H. Holz, K. Merrill, R. Sudesh, and K. Karlen, “Surgical management of pediatric limbal dermoids with sutureless amniotic membrane transplantation and augmentation,” J. Pediatr. Ophthalmol. Strabismus, vol. 49, no. 2, pp. 114–119, Mar. 2012.
- S. J. Lang, D. Böhringer, and T. Reinhard, “Surgical management of corneal limbal dermoids: Retrospective study of different techniques and use of Mitomycin C,” Eye, vol. 28, no. 7, pp. 857–862, 2014. .
- F.S. Brightbill (Ed.), Corneal Surgery: Theory, Technique, and Tissue (ed 3), Mosby, St. Louis, MO (1999)
- Y. Yao, M. Z. Zhang, and V. Jhanji, “Surgical management of limbal dermoids: 10-year review,” Acta Ophthalmologica, vol. 95, no. 6. Blackwell Publishing Ltd, pp. e517–e518, 01-Sep-2017.
- Y. D. Shen, W. L. Chen, I. J. Wang, Y. C. Hou, and F. R. Hu, “Full-thickness central corneal grafts in lamellar keratoscleroplasty to treat limbal dermoids,” Ophthalmology, vol. 112, no. 11, pp. 1955.e1-1955.e10, 2005.
- P. Pawar and S. Shah, “Limbal Stem Cell Transplantation for Limbal Dermoid in a Case of Goldenhar Syndrome,” MVP J. Med. Sci., vol. 1, no. 2, p. 97, 2014.
- J. Jeong, Y. J. Song, S. Il Jung, and J. W. Kwon, “New surgical approach for limbal dermoids in children: Simple excision, corneal tattooing, and sutureless limbo conjunctival autograft,” Cornea, vol. 34, no. 6, pp. 720–723, Apr. 2015.
- W. H. Cho, M. T. Sung, P. W. Lin, and H. J. Yu, “Progressive large pediatric corneal limbal dermoid management with tissue glue-assisted monolayer amniotic membrane transplantation,” Med. (United States), vol. 97, no. 46, Nov. 2018.
- Mader, TH, Stulting D. Technique for the Removal of Limbal Dermoids. Cornea, vol. 17, no. 1, pp. 66–67, 1998.
- K. Yamashita, S. Hatou, Y. Uchino, K. Tsubota, and S. Shimmura, “Prognosis after lamellar keratoplasty for limbal dermoids using preserved corneas,” Jpn. J. Ophthalmol., vol. 63, no. 1, pp. 56–64, Jan. 2019.
- I. Wu et al., “Surgical Management of Limbal Dermoids Using Anterior Corneal Buttons from Descemet Stripping Automated Endothelial Keratoplasty Donor Tissue as Patch Grafts,” Cornea, vol. 36, no. 1, pp. 64–67, Jan. 2017.
- S. Jacob, S. Narasimhan, A. Agarwal, A. Agarwal, and S. AI, “Combined interface tattooing and fibrin glue–assisted sutureless corneal resurfacing with donor lenticule obtained from small-incision lenticule extraction for limbal dermoid,” J. Cataract Refract. Surg., vol. 43, no. 11, pp. 1371–1375, Nov. 2017.
- D. R. Lazzaro and R. Coe, “Repair of limbal dermoid with excision and placement of a circumlimbal pericardial graft,” Eye Contact Lens, vol. 36, no. 4, pp. 228–229, Jul. 2010.
- A. Şimşek, Ş. Bilak, L. Balyen, and I. H. Erdoʇdu, “Conservative surgical management of a grade III corneal dermoid,” Cornea, vol. 34, no. 10, pp. 1318–1320, Jul. 2015.
- D. Saha, R. K. Sinha, and K. Bhavsar, “Online Journal of Health and Allied Sciences,” Online J. Heal. Allied Sci., vol. 10, no. 1, pp. 1–4, 2011.
- D. M. Cha, K. H. Shin, K. H. Kim, and J. W. Kwon, “Simple keratectomy and corneal tattooing for limbal dermoids: Results of a 3-year study,” Int. J. Ophthalmol., vol. 6, no. 4, pp. 463–466, 2013.
- Mannis MJ, Eghbali K and Schwab IR. Keratopigmentation: a review of corneal tattooing. Cornea 1999; 18: 633–637
- https://eyewiki.aao.org/Eye_Tattooing#Corneal_tattooing
- P. Bandivadekar, T. Agarwal, and S. Temkar, “Shave excision with keratopigmentation for limbal dermoid,” Eye Contact Lens, vol. 44, no. 2, pp. E7–E9, Mar. 2018.
- S. Milenković, N. Kosanović-Jaković, S. Djurić, D. Risimić, and M. Ivančević-Milenković, “Helicoidal peripapillary degeneration [3],” Eye, vol. 19, no. 8. Nature Publishing Group, pp. 917–920, 2005.
- P. Watts, A. Michaeli-Cohen, M. Abdolell, and D. Rootman, “Outcome of lamellar keratoplasty for limbal dermoids in children,” J. AAPOS, vol. 6, no. 4, pp. 209–215, 2002.
Autores

María Agustina Borrone
– Instituto de La Vision. CABA. Marcelo T de Alvear 2261, Ciudad Autónoma de Buenos Aires, Argentina

Carlos Rocha de Lossada
– Fellowship Córnea y segmento anterior del Hospital Clinic de Barcelona

1 Comentarios
Irene Sassot
marzo 2, 2020Hola, cómo acabó el caso? Qué tal una queratoplastia lamelar anterior profunda con "top hat" inferior + disección lamelar inferior en la zona del dermoide ?