Introducción
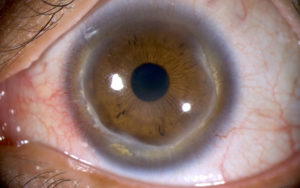
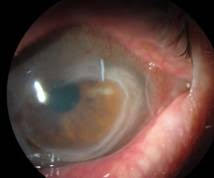
A raíz del caso expuesto por el Dr. Miguel Srur, donde se presentaba una lesión periférica corneal con depósitos lipídicos se abrió el debate sobre la Degeneración Marginal de Terrien. Se trataba de un paciente de 17 años sin antecedentes de interés, con afectación unilateral de OD y con cilindro contra la regla de 4.5D.
La Degeneración Marginal de Terrien (DMT) fue descrita por dicho Oftalmólogo francés en 1900, como una ectasia marginal y bilateral de la córnea(1).
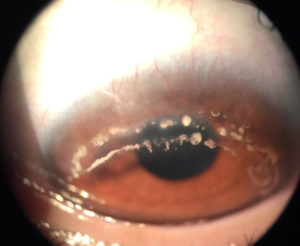
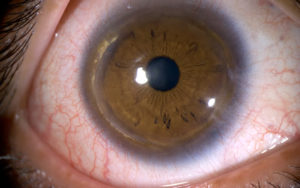
Sus datos clínicos característicos son: adelgazamiento y formación de un surco en córnea periférica lentamente progresivo; vascularización superficial con un trayecto radial tortuoso y de apariencia circunferencial en la zona más adelgazada; depósito de lípidos en el extremo del borde afectado; epitelio íntegro con ausencia de signos y síntomas de inflamación, astigmatismo contra la regla progresivo(2).
Etiología
Su causa es desconocida, barajándose varias hipótesis:
- Origen degenerativo: su lenta progresión, así como la ausencia de síntomas, y el depósito lipídico lo hacen característico de los procesos degenerativos.
- Origen inflamatorio: las células epiteliales degeneradas secretarían un componente inmunogénico que resultaría en hipersensibilidad. Esto explicaría los casos que cursan con dolor, fotofobia, inyección conjuntival y / o tinción con fluoresceína.
- Fagocitosis del colágeno por los histiocitos: según esta hipótesis los histiocitos emigrarían desde los capilares hacia el área afectada para fagocitar el colágeno estromal.
Las hipótesis anteriores están basadas en los hallazgos histopatológicos de los especímenes de cirugía de casos avanzados(2). Recientemente, gracias al uso del Microscopio Confocal, se ha obtenido información acerca de los estadios más precoces. Ceresara et al(3) encontraron nidos de linfocitos y células de Langerhans en pacientes con DMT. La presencia de estas células de Langerhans (presentadoras de antígenos) evidencia cierta respuesta inmune, no obstante, no toda respuesta inmune lleva a inflamación. Esta actividad podría llevar a un cambio gradual de la morfología y función normal de los queratocitos estromales, haciendo a su vez que secreten citoquinas que inducen neovascularización. No obstante, se necesitan más estudios que avalen dicha hipótesis.
Epidemiología
Su incidencia no ha sido reportada. Aunque puede aparecer a cualquier edad, es más común que comience entre la 2º y 4º década de la vida. Según la literatura, es más frecuente por encima de los 40 años y en varones (ratio de 3:1)(4). También lo confirma el estudio retrospectivo de 25 casos de Chan et al.(5)
Patología
Los cambios que se aprecian tanto por microscopía electrónica como por la anatomía patológica, constan de adelgazamiento estromal con alteraciones en la membrana basal epitelial y en la membrana de Bowman. También existe una vacuolización del colágeno estromal y una intensa infiltración lipídica. La presencia de células inflamatorias es escasa. La membrana de Descemet puede aparecer engrosada, focalmente desprendida, rota, separada en capas o inclusive no estar presente(6).
Un análisis Inmunohistoquímico de casos de DMT y la Úlcera de Mooren, mostró que menos del 25% de DMT expresaban complejos mayores de histocompatibilidad tipo II en comparación con el 75-100% de las células en la Úlcera de Mooren. El ratio CD4:CD8 en DMT fue de 1:1, mientras que en el Mooren fue de 24:1(7). Además en la DMT muestran una escasa infiltración por células tipo B en comparación con Mooren.
Clínica
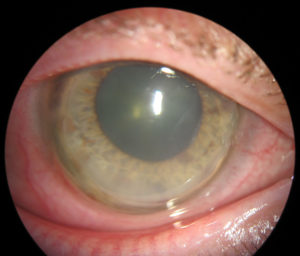
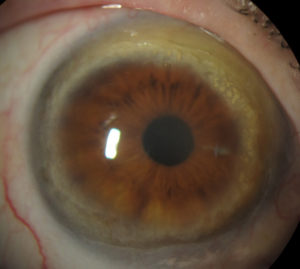
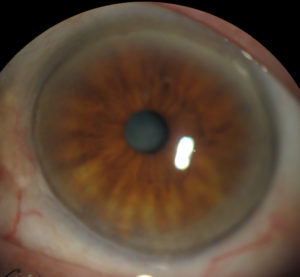
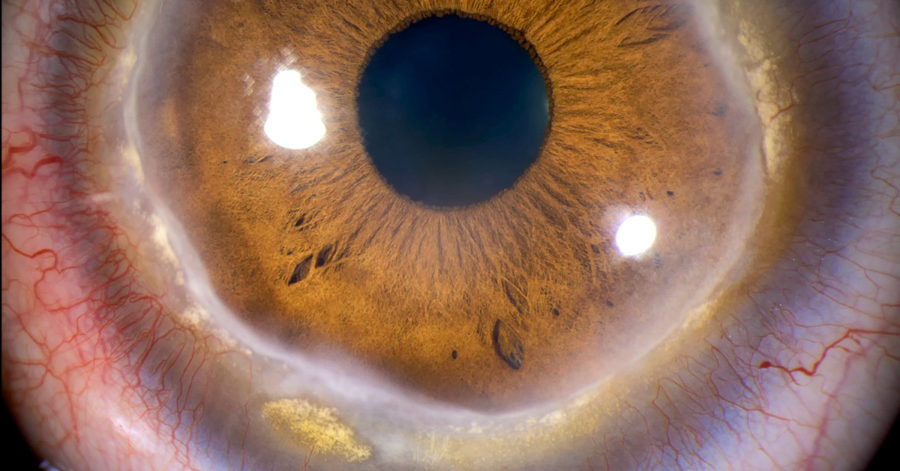
Se trata de una entidad definida clásicamente como no inflamatoria, de carácter bilateral y lentamente progresivo. La presentación puede ser tanto simétrica como asimétrica, y en este caso, el ojo contra lateral puede afectarse incluso décadas después del primero. La primera manifestación suele localizarse supero nasal, aunque gradualmente puede extenderse de modo circunferencial y abarcar los 360º de la córnea. Comienza con pequeñas opacidades finas puntiformes en el estroma anterior, existiendo una zona de córnea clara hasta el limbo. Posteriormente pasa a convertirse en la línea de depósito amarillo blanquecina de lípidos en uno de los bordes.
Se acompaña de vascularización fina superficial con una trayectoria radial y característicamente el epitelio permanece intacto (lo que nos hace diferenciarlo de otras entidades como la úlcera de Mooren).
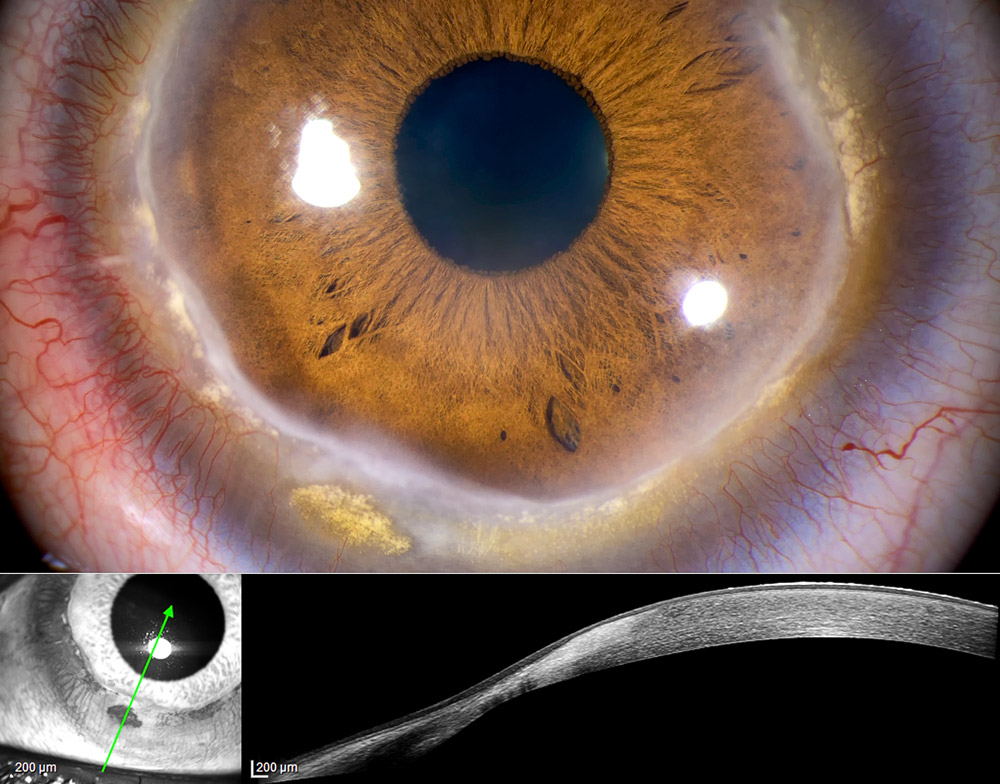
Agradecemos al Dr. Jesús Conejero Arroyo la aportación de un caso clínico y excelente iconografía. La siguiente imagen “Terrien’s Marginal Degeneration”, recibió el 2º premio en la Cross Categories 49th Annual OPS Educational Program. AAO Anual Meeting. Chicago. Illinois. October 2018
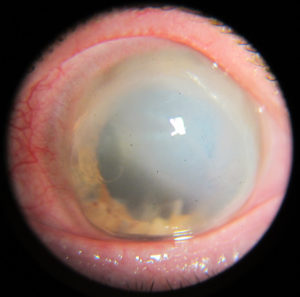
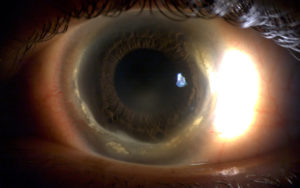
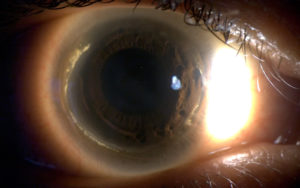
El estroma corneal puede sufrir un adelgazamiento progresivo a lo largo de los años (hasta 10-20 años), pudiendo desembocar en ectasia de dicha zona. Están descritos casos incluso de Hydrops y de ampollas conjuntivales filtrantes(2,4,5).
En cuanto a los síntomas, generalmente suele ser asintomático, pero puede acompañarse de molestias ocasionales.
Iwamoto et al(6) clasificaron la DMT en dos grupos: inflamatoria y quiescente. En la forma inflamatoria existirían síntomas de irritación, quemazón, vasos conjuntivales tortuosos y tinción de fluoresceína; no así en la quiescente. Es difícil determinar una relación causal entre la inflamación y la DMT.
Hay autores que opinan que estos casos de DMT “inflamatorios” deberían considerarse casos más leves de otras entidades como la úlcera de Mooren.
La DMT ha sido asociada tanto a distrofias corneales como la distrofia polimorfa posterior(8) y distrofias de la membrana basal epitelial(9). También se ha descrito coexistiendo con procesos inflamatorios como queratoconjuntivitis vernal(10) y eritema elevatum diutinum (un tipo infrecuente de vasculitis leucocitoclástica caracterizada por lesiones en la piel de placas sobre elevadas)(11) y artritis reumatoide(12). En la serie de Chan et al(5) retrospectivo de 25 pacientes, el 40% (10 pacientes) presentaban como comorbilidad más frecuente la disfunción de las glándulas de Meibomio. Asimismo, un 20% (5 pacientes) mostraron signos tanto de rosácea ocular y/o sistémica.
El adelgazamiento progresivo de la córnea puede llevar a un astigmatismo en contra de la regla u oblicuo y causar disminución de la agudeza visual.
Este adelgazamiento y por tanto, aplanamiento de la parte superior lleva a un incurvamiento del meridiano perpendicular al meridiano adelgazado. Chan et al en su grupo de 25 pacientes (43 ojos) mostraron un astigmatismo medio topográfico de 4.02D a 5º(5). A pesar de que la progresión de la enfermedad es lenta, se ha descrito un aumento de hasta 1.68 D en el valor del astigmatismo durante el seguimiento en 3 años después del diagnóstico(5).
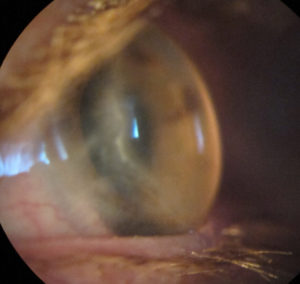
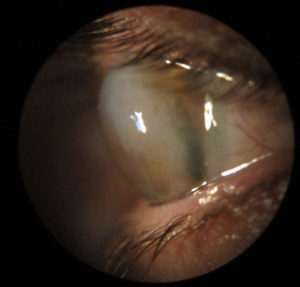
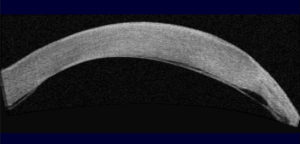
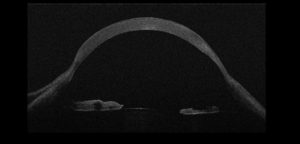
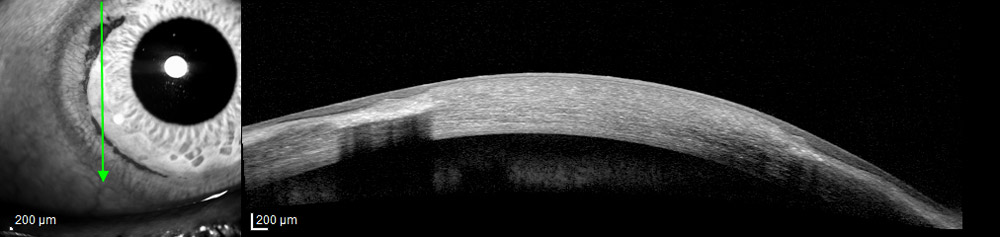
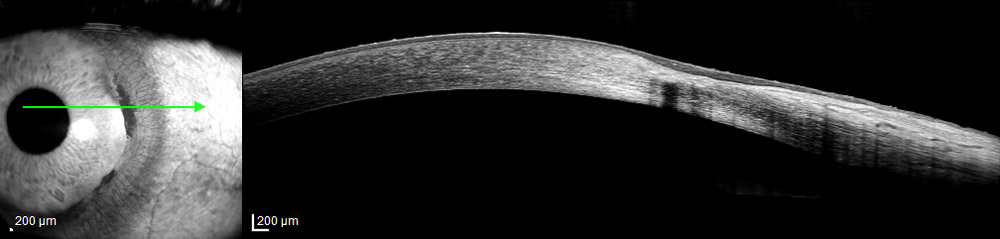
En cuanto al riesgo de perforación ha sido descrito clásicamente del 15%. Siendo concordante con los datos obtenidos por Chan et al, 11.6%(5). Se han reportado casos de desprendimiento de Descemet, así como Hydrops. Nosotros tenemos el caso de una paciente de 60 años con diagnóstico previo de DMT de más de 30 años de evolución, que acude por Hydrops en ojo izquierdo. Presentamos la imagen de la biomicroscopía de ambos ojos y la OCT de ojo izquierdo durante el episodio de Hydrops y tras su resolución.
Diagnóstico
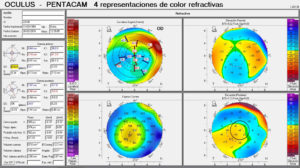
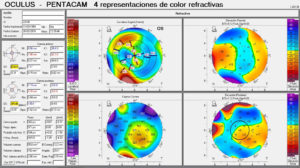
El diagnóstico es básicamente clínico. Las pruebas complementarias como la topografía resultan útiles para establecer el diagnóstico y poder diferenciarlo de otras ectasias corneales. En la topografía, la zona adelgazada periférica puede no detectarse en los mapas paquimétricos. El patrón topográfico es variable dependiendo del grado de afectación, generalmente existe un astigmatismo irregular(13).
Skribek A et al describió la utilidad de la biomicroscopía ultrasónica en el control y seguimiento de la DMT, evidenciando el adelgazamiento estromal(14).
El caso del Dr. Conejero, cuyos detalles clínicos mostramos a continuación, corresponde a un varón de 32 años que presentaba en ambos ojos depósitos lipídicos y adelgazamiento de 360º. Mostrando una agudeza visual (AV) de 1.00 en ambos ojos y ausencia de signos de inflamación. La topografía muestra un patrón irregular de astigmatismo a favor de la regla de baja magnitud, hallazgo que podría achacarse a que existe una afectación de 360º.
Actualmente, la OCT de segmento anterior nos permite describir mejor los cambios morfológicos a nivel de la zona de la lesión y obtener una mayor precisión en cuanto a la medición de la zona más fina, fundamental para el planteamiento quirúrgico y evitar posibles perforaciones(15).
Incluso nos puede resultar de ayuda a la hora de diferenciar un adelgazamiento corneal de origen inflamatorio o no inflamatorio; tal como describen Rodriguez et al.(16) donde 5 casos de degeneración corneal periférica con antecedentes de síntomas y/o signos inflamatorios, sin historia de defecto epitelial previo presentaban una banda estromal hiperreflectante justo por debajo del epitelio y en la zona más adelgazada(16).
Diagnóstico diferencial
Se plantea con otras enfermedades corneales:
- Úlcera de Mooren: Manifiesta una clínica más llamativa de dolor ocular, fotofobia, lagrimeo y progresa rápidamente con la posibilidad de perforación en poco tiempo de evolución. Presenta afectación del epitelio y tinción positiva a la fluoresceína. Puede haber afectación de epiesclera, esclera adyacente a la úlcera. No deja margen de córnea clara entre limbo y zona de úlcera afectada. Aparece en adultos, sin predilección de sexo. Puede ser unilateral en los casos limitados o bilaterales en el tipo maligno.
- Queratitis ulcerativa periférica (PUK). Como factores de riesgo, la asociación a enfermedades sistémicas del colágeno y vasculares como artritis reumatoide, granulomatosis con poliangitis. Muestran una afectación de cualquier parte de la córnea periférica, acompañados de gran sintomatología ocular: dolor, fotofobia, lagrimeo. Existe adelgazamiento progresivo estromal junto con pérdida del epitelio, así como afectación escleral(17).
- Queratitis superficial Marginal de Fuchs. Se desconoce su asociación a factores de riesgo. Cursa con brotes episódicos de inflamación que lleva a infiltrados marginales y adelgazamiento irregular periférico. Es característico la presencia de una banda grisácea que separa la zona afectada de la córnea central. Puede acompañarse o no de pseudopterigion(18).
- Queratitis infecciosas que afectan a la periferia corneal. Como factores de riesgo: antecedente de traumatismo, usuario de lentes de contacto. Pueden aparecer en cualquier parte de la córnea, generalmente unilateralmente. Se trata de lesiones con rápida progresión. Clínica variada desde infiltrados purulentos, acompañados de vascularización, edema corneal, con pliegues en Descemet, precipitados endoteliales, inyección periquerática… hasta hipopion.
- Degeneración Marginal Pelúcida. Característicamente aparece en córnea periférica inferior. Cursa con disminución de AV por astigmatismo creciente en contra de la regla. Banda bilateral lentamente progresiva de adelgazamiento corneal inferior a 1-2mm del limbo.
- Degeneración en surco (Corneal Furrow degeneration). Se trata de un adelgazamiento periférico bilateral que afecta a pacientes mayores. Característicamente no presentan ni inflamación, ni vascularización ni inducen astigmatismo. Suelen ser asintomáticos.
Tratamiento
- No quirúrgico
- Hasta la fecha no existe un tratamiento farmacológico que evite la progresión de la enfermedad. El manejo es conservador. En casos de afectación meibomiana, requerirán de medidas habituales de limpieza etc… , si existen molestias por alteración de la película lagrimal, serán manejados mediante lubricantes, y corticoides suaves ocasionales.
Corrección óptica si precisan, ya sea en forma de gafas o lentes (rígidas gas permeable, esclerales…)
- Hasta la fecha no existe un tratamiento farmacológico que evite la progresión de la enfermedad. El manejo es conservador. En casos de afectación meibomiana, requerirán de medidas habituales de limpieza etc… , si existen molestias por alteración de la película lagrimal, serán manejados mediante lubricantes, y corticoides suaves ocasionales.
- Quirúrgico
- Cirugías tectónicas: Se pueden utilizar flaps conjuntivales y autoinjertos esclerales en aquellos casos de que no sea posible conseguir una córnea donante.
- Cirugías con fines ópticos: En estos casos, se busca mejorar la AV así como la anatomía del ojo. Por lo que requerirán la extirpación del tejido ectásico y su reemplazo mediante un trasplante parcial, total o lamelar.
Entre ellos, la técnica más usada es el trasplante lamelar utilizando un botón donante de la forma y profundidad similar a la zona de la DMT(19,20). Se puede tallar el botón anular, en forma de C y de un tamaño 0,25-0.5 mm más pequeño que la zona receptora, con el fin de poder aplanar mediante suturas más compresivas la zona ectásica(21). También, se puede utilizar el anillo esclerocorneal sobrante preservado en glicerina con buenos resultados(22).
Otras técnicas modificadas serían la queratoplastia lamelar “tuck-in”, en donde se talla un bolsillo intraestromal periférico para un mejor acoplamiento del botón y la zona receptora(23). Así como la técnica de “sutura con pliegue” descrito en el Queratoglobo, donde se crea un pliegue en la córnea receptora con el fin de mejorar el diámetro blanco-blanco(24). El femtosegundo podría tener su papel a la hora de tallar de forma más uniforme el lecho receptor.
Dado que la DMT se trata de una patología crónica y lenta, la cirugía siempre se ha retrasado lo máximo posible. No obstante, un adelgazamiento excesivo del estroma y su consecuente aumento del riesgo perforación durante la cirugía llevan a un pronóstico visual peor que si la cirugía es llevada a cabo precozmente.
Es por ello que aunque no existe consenso de cuándo plantear la cirugía, Li et al recomiendan la cirugía cuando el espesor corneal alcanza las 150 micras(19).
A pesar de todo ello, también encontramos en la literatura casos de pequeñas perforaciones que han sido manejadas conservadoramente mediante pegamento biológico o con lente terapéutica.
Otra opción de tratamiento descrita es el Cross-linking. Su efecto sobre las ectasias corneales está descrito en el Queratocono, pero no tanto para la DMT.
Hafezi(25) publicó un caso de DMT tratado mediante cross-linking; notificando el cese de su progresión y adelgazamiento, con mejoría de la AV. Describe incluso mejoría del grosor corneal en la zona más delgada. Más recientemente, Lamarca et al(26) describen un caso de DMT tratado exitosamente mediante cross-linking, con estabilización de las K topográficas y mejoría de su AV sin efectos secundarios a casi 10 años de seguimiento. Parece que este efecto se debe a que el cross-linking inhibiría la digestión enzimática del estroma corneal, estabilizando la zona de mayor adelgazamiento.
Asimismo no olvidar aconsejar al paciente sobre su enfermedad, su curso y diferentes opciones de tratamiento según qué estadio. Debe evitarse el frotamiento ocular a toda costa y protección ocular ante traumatismos cuando exista riesgo de perforación espontánea. Serían recomendables las revisiones periódicas con OCT cada 3 meses a partir de 250 micras de grosor corneal(2).
Conclusión
La DMT es una degeneración de curso lentamente progresivo, bilateral y asimétrico. Caracterizada por un depósito lipídico, neovascularización y adelgazamiento progresivo periférico, siendo más frecuente que comience en la parte superior. Es una entidad poco frecuente, cuya etiología permanece incierta a día de hoy, pero que se debe de tener en cuenta en el diagnóstico diferencial de las degeneraciones corneales.
Aunque es diagnóstico es fundamentalmente clínico, las pruebas complementarias demuestran ser de gran ayuda de cara al seguimiento y al planteamiento quirúrgico, con el objetivo de mejorar el pronóstico visual del paciente.
Bibliografía
- Terrien F. Dystrophie marginale symétrique des deux cornées avec astigmatisme régulier consécutif et guérison par la cautérisation ignée. Arch Opthalmol. 1900; 20: 12-21.)
- Ding Y, Murri MS, Birdsong OC, Ronquillo Y, Moshirfar M. Terrien marginal degeneration. Surv Ophthalmol. 2019 Mar-Apr; 64(2):162-174.
- Ceresara G, Migliavacca L, Orzalesi N, Rossetti L. In vivo confocal microscopy in Terrien marginal corneal degeneration: a case report. Cornea. 2011 Jul; 30(7):820-4.
- Mannis MJ, Holland EJ. Cornea. Fourth. Elsevier; 2017.
- Chan AT, Ulate R, Goldich Y, Rootman DS, Chan CC. Terrien Marginal Degeneration: Clinical Characteristics and Outcomes. Am J Ophthalmol. 2015 Nov; 160(5):867-872.
- Iwamoto T, DeVoe A, Farris RL. Electron microscopy in cases of marginal degeneration of the cornea. Invest Ophthalmol. 1972; 11(4):241-257.
- Lopez J, Price FWJ, Whitcup SM, Li Q, Smet M De, Chan C. Immunohistochemistry of terrien’s and mooren’s corneal degeneration. Arch Ophthalmol. 1991; 109(7):988-992.
- Wagoner MD, Teichmann KD. Terrien’s marginal degeneration associated with posterior polymorphous dystrophy. Cornea 1999; 18:612-15.
- Donshik PC, Tedesco K, Carlton R, et al. Terrien’s marginal degeneration associated with central anterior basement membrane-like dystrophic changes. Cornea 1987; 6:246-9.
- Kremer I. Terrien’s marginal degeneration associated with vernal conjunctivitis. Am J Ophthalmol 1991; 111:517-18.
- Shimazaki J, Yang H, Shimmura S, et al. Terrien’s marginal degeneration associated with erythema elevatum diutinum. Cornea 1998; 17:342-4.
- Zarei-Ghanavati S, Javadi M-A, Yazdani S. Bilateral Terrien’s Marginal Degeneration and posterior polymorphous dystrophy in a patient with rheumatoid arthritis. J Ophthalmic Vis Res. 201; 7(1):60-63.
- Fernandes M. Scanning slit topography: diagnostic boon in presumed unilateral Terrien’s marginal degeneration. Cont Lens Anterior Eye. 2011 Dec; 34(6):282-6.
- Skribek A, Sohar N, Gyetvai T, Nogradi A, Kolozsvari L. Role of ultrasound biomicroscopy in diagnosis and treatment of Terrien Disease. Cornea.2008; 27(4).
- Wang N, Wang CX, Lian XF, Duan SJ, Huang D, Zhou SY. Staging of development in Terrien’s degeneration based on corneal curvatures detected by optical coherence tomography. Graefes Arch Clin Exp Ophthalmol. 2015 Oct; 253(10):1757-64.
- Rodriguez M, Yesilirmak N, Chhadva P, Goldhagen B, Karp C, Galor A. High-Resolution Optical Coherence Tomography in the Differentiation of Inflammatory Versus Noninflammatory Peripheral Corneal Thinning. 2017 Jan; 36(1):48-52.
- Keenan JD, Mandel MR, Margolis TP. Peripheral ulcerative keratitis associated with vasculitis manifesting asymmetrically as fuchs superficial marginal keratitis and terrien marginal degeneration. Cornea. 2011 Jul; 30(7):825-7.
- Cheung AY, Sarnicola E, Kurji KH, Genereux BM, Holland EJ. Three Hundred Sixty-Degree Fuchs Superficial Marginal Keratitis Managed With Annular Lamellar Keratoplasty. 2018 Feb; 37(2):260-262.
- Li L, Zhai H, Xie L, Cheng J, Liu W. Therapeutic Effects of Lamellar Keratoplasty on Terrien Marginal Degeneration. 2018 Mar; 37(3):318-325.
- Fernandes M, Vira D. Patch Graft for Corneal Perforation Following Trivial Trauma in Bilateral Terrien’s Marginal Degeneration. Middle East Afr J Ophthalmol. 2015 Apr-Jun; 22(2):255-7.
- Cheng CL, Theng JT, Tan DT. Compressive C-shaped lamellar keratoplasty: a surgical alternative for the management of severe astigmatism from peripheral corneal degeneration. 2005 Mar; 112(3):425-30.
- Gao H, Wang X, Echegaray JJ, Li S, Wang T, Shi W. Partial lamellar keratoplasty for peripheral corneal disease using a graft from the glycerin-preserved corneoscleral rim. Graefes Arch Clin Exp Ophthalmol. 2014 Jun; 252(6):963-8.
- Maharana PK, Dubey A, Jhanji V, Sharma N, Das S, Vajpayee RB. Management of advanced corneal ectasias. Br J Ophthalmol. 2016 Jan; 100(1):34-40.
- Lockington D, Ramaesh K. Use of a novel lamellar keratoplasty with pleat technique to address the abnormal white-to-white diameter in keratoglobus. 2015 Feb; 34(2):239-42.
- Hafezi F, Gatzioufas Z, Seiler TG, Seiler T. Corneal collagen cross-linking for Terrien marginal degeneration. J Refract Surg. 2014 Jul; 30(7):498-500.
- Lamarca J, Salvador-Culla B, Fernández-Vega C, Barraquer RI. Long-term Results of Corneal Cross-linking for Terrien’s Marginal Degeneration. J Refract Surg. 2018 Jun 1; 34(6):424-429.
Autor

Dra. Naon Kim
Adjunto de superficie ocular y córnea
Hospital Universitario Torrejón
Bajo supervisión de:
Dra. Paz Rodríguez Ausín
Jefe de Servicio de Oftalmología
Hospital Universitario Torrejón