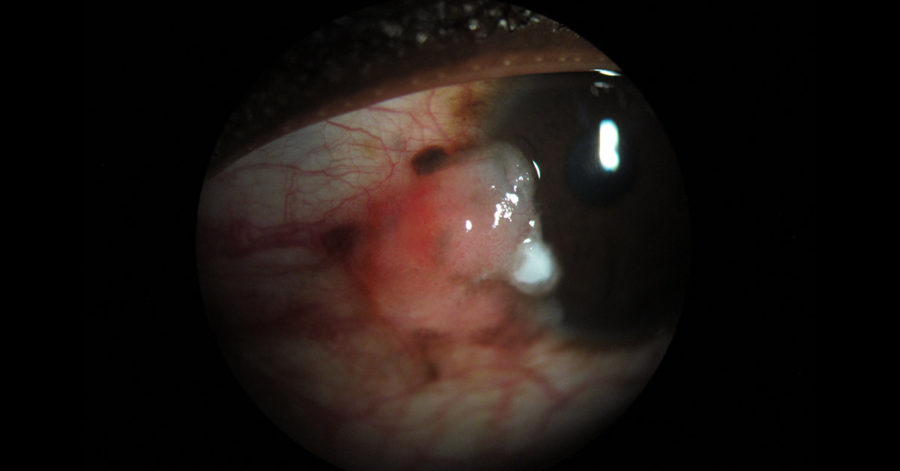
La Neoplasia Escamosa de la Superficie Ocular (OSSN) es la lesión maligna no pigmentada mas frecuente que aparece en el epitelio conjuntival y corneal.
El término OSSN, incluye un amplio espectro histológico; desde la displasia leve al carcinoma escamoso celular invasivo. (1)
A raíz de los casos presentados en el Foro de Facoelche por los Dres. José Manuel Gómez, y Juan Manuel Fuentes, se iniciaron un interesante hilo sobre la Neoplasia escamosa. El Dr. Luis Lu, inició el debate con sus interesantes aportaciones acerca de las pautas de tratamiento con 5 Fluoracilo tópico.
I. CLASIFICACIÓN
Dentro de OSSN hablamos de:
- Neoplasia conjuntival intraepitelial, habitualmente denominado “CIN” (Conjunctival Intraepithelial Neoplasia) aquella en la que las células neoplásicas están confinadas en la capa epitelial con la membrana basal intacta (Figura 1). Antiguamente ha sido referido como Enfermedad de Bowen, Displasia escamosa conjuntival, Epitelioma intraepitelial, Carcinoma in situ, Disqueratosis (1)
- Neoplasia invasiva escamosa de la superficie ocular, “SSC” (Surface Squamous Neoplasia or Invasive ocular Surface Squamous Neoplasia). En ella, las células neoplasicas epiteliales penetran la membrana basal. Frecuentemente un CIN suele ser precursor del SSC. En caso de neoplasia limbar, y debido a la resistencia mayor de la membrana de Bowman, la invasión suele estar limitada a la parte conjuntival de la lesión. (1)
II. INCIDENCIA
Se ha descrito una incidencia de SCC de 0.03-1.9 / 100,000 / año en población caucásica en Estados Unidos y Australia. Mientras que en población africana es del 3-3.4 por 100,000/ año. (2,3)
III. FACTORES DE RIESGO DE OSSN
El factor de riesgo ambiental más importante es la exposición solar crónica (radiación ultravioleta B). Según un estudio poblacional en Australia, individuos con piel clara, ojos claros y con mayor predisposición a quemaduras solares que pasan más del 50 % del tiempo al aire libre durante los 6 primeros años de vida y que vivan entre los 30º del ecuador son los que tienen mayor riesgo de desarrollar este tumor. (4)
También se incluyen otros factores de riesgo ambientales, como la exposición al humo del tabaco y derivados del petróleo, deficiencia de vitamina A y retinol (2),así como el sexo masculino y la edad. Se ha visto mayor incidencia en hombres que en mujeres; en el caso de Estados Unidos, se estima que en hombres y caucásicos esta cifra es 5 veces superior. (3) En los países de África no hay diferencias en cuanto a sexo. (3)
Se ha hablado de la incidencia de OSSN en pterigium. Oelleres et al encuentran una incidencia de 1.7% de OSSN en pterigion que fueron analizados tras excisión, de los cuales 41 % fueron clínicamente sospechosos (5).
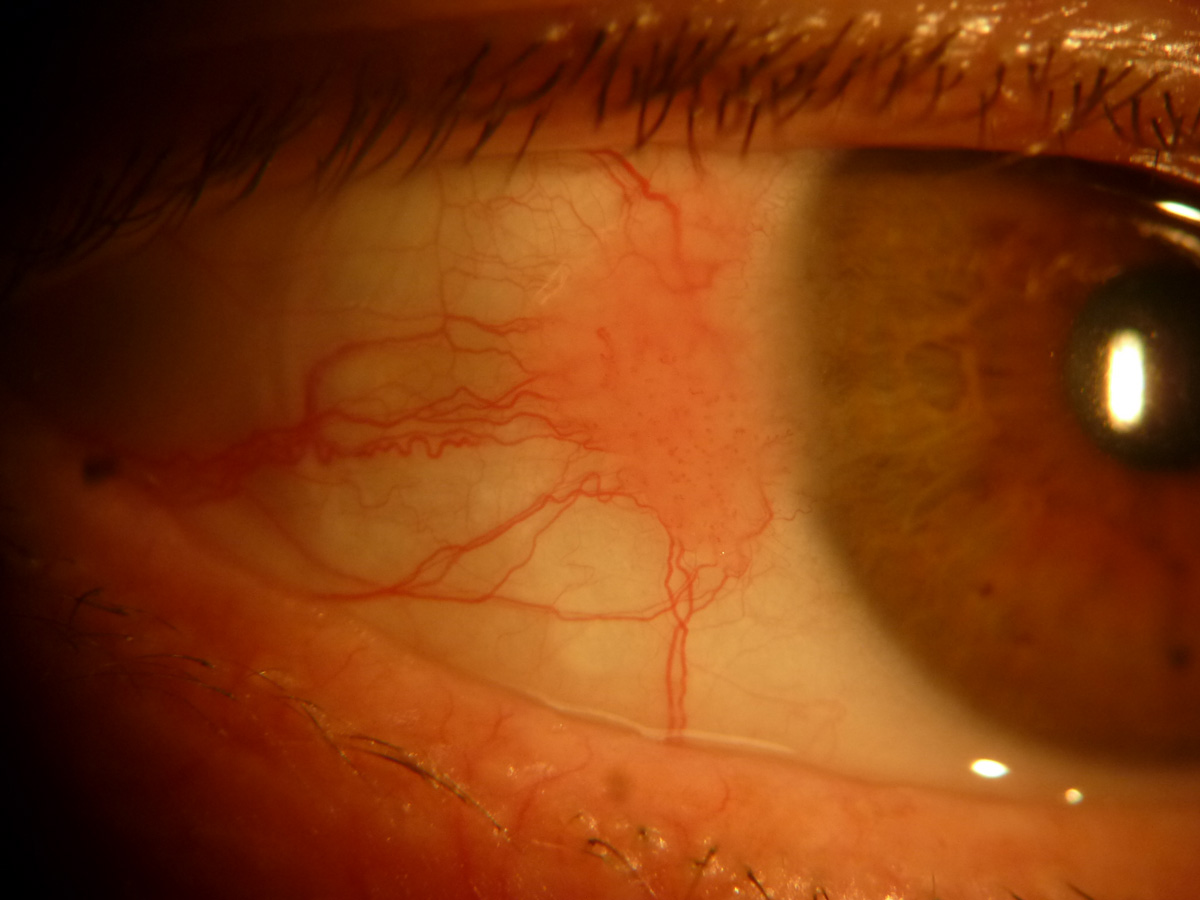
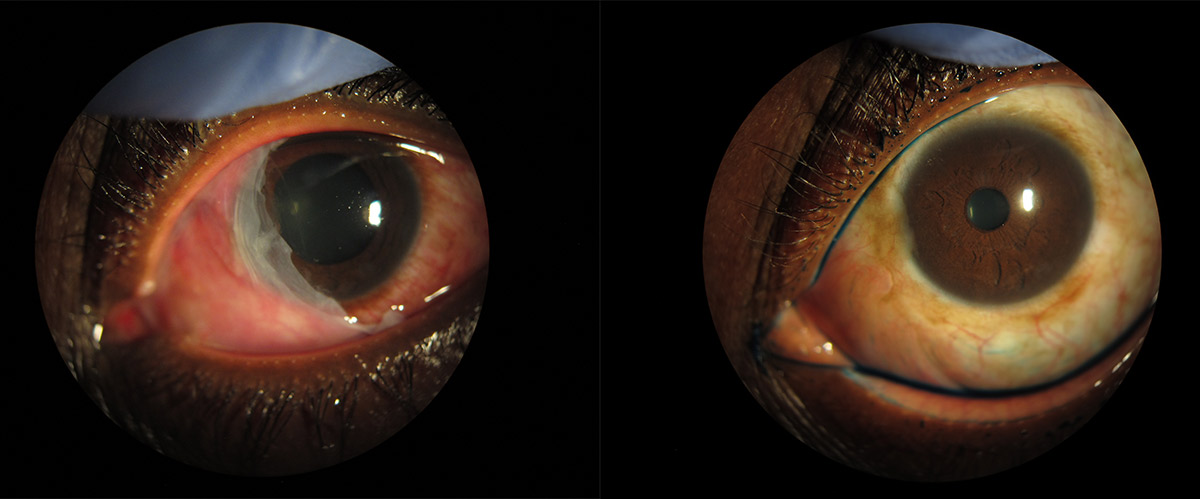
Uno de los factores predisponentes más importantes es el estado del sistema inmunológico del paciente. Sobre todo en los casos de infección por HIV tienen un riesgo ocho veces superior de padecer OSSN. (Figura 2) Se presentan en edades más tempranas, suelen ser bilaterales, tienen peor evolución, peor pronóstico y mayor riesgo de recurrencias. (2,3,6)
También son más frecuentes en otros casos de inmunosupresión pos-trasplante, linfomas no Hodgkin, asma, atópicos, eczemas, xeroderma pigmentosum y otras enfermedades autoinmunes. Parece que la infección por el virus papiloma humano (HPV serotipos 16 y 18) e infecciones crónicas por virus de la hepatitis B y C podrían tener un papel en la patogenia de la OSSN aunque no se ha demostrado una correlación clara. (2,3)
No está descrita ninguna relación clara de mutaciones genéticas con las OSSN. Sin embargo parece que uno de los eventos claves es la mutación que afecta al gen supresor de tumores p53, lo que confirma el rol de las radiaciones ultravioletas en la etiología de este tumor. (2)
IV. CLÍNICA(1,2)
Suele presentarse como una lesión limbar vascularizada unilateral en el área interpalpebral, que es la que presenta mayor exposición solar. Más raramente pueden ser bilaterales o masas multifocales.
El aspecto macroscópico es una lesión de coloración amarillo-rosado con vasos tortuosos dilatados en forma de tirabuzón. En personas de piel oscura, frecuentemente están pigmentados.
Se pueden clasificar según su forma en:
- nodular
- nódulo-ulcerativo
- gelatinoso
- leucopláquicos ( placa blanquecina por la hiperqueratinización)
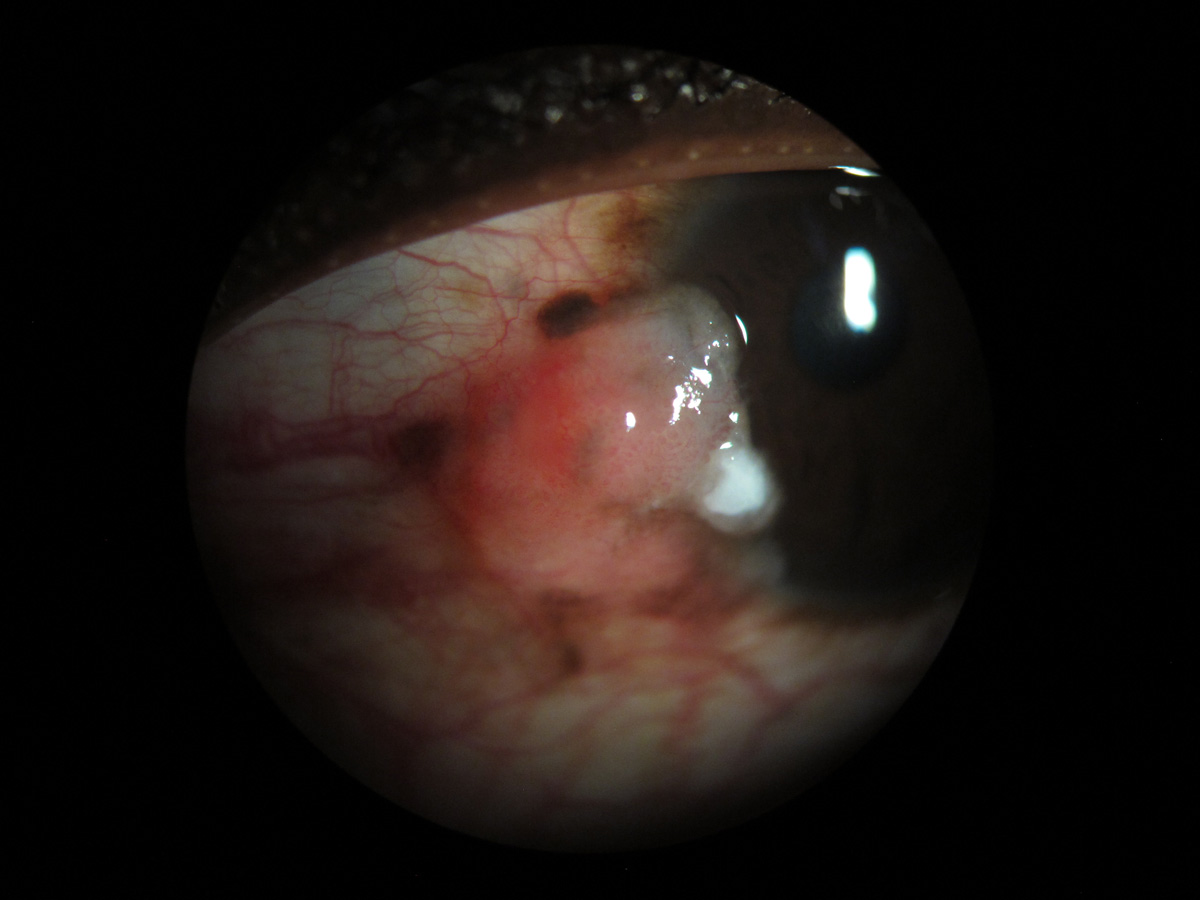
- papilar (Figura 3)
En los casos con HIV, las lesiones suelen ser de mayor tamaño, con extensión a fórnix, áreas de leucoplaquia y pronunciados vasos nutricios.
Otras formas clínicas menos obvias de presentación son una opalescencia sobre la córnea o una conjuntivitis crónicas.
Los síntomas y signos clínicos más frecuentes son ojo rojo, irritación ocular y la aparición de una tumoración no existente previamente en la superficie ocular. En casos avanzados puede llegar a escleritis necrotizante, con dolor severo y pérdida de agudeza visual. En ocasiones, una neoplasia escamosa puede invadir el estroma corneal, mimificando una queratitis estromal. (Figura 4)
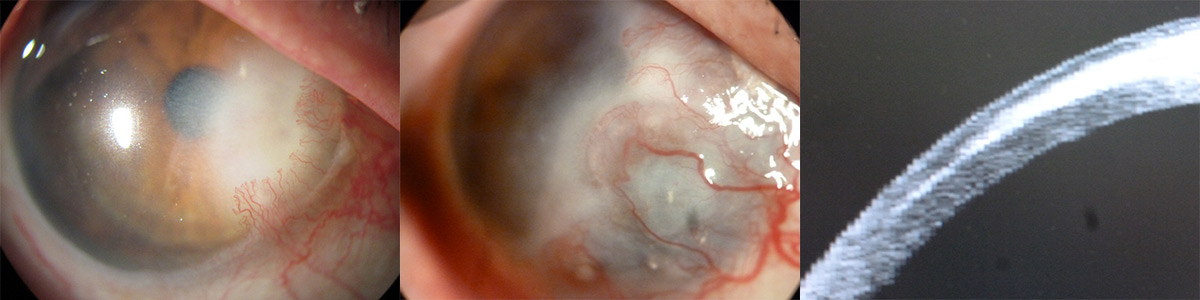
En los casos de OSSN invasivo, clínicamente las lesiones son similares al CIN pero más elevadas, de mayor tamaño, afectando a mayor parte del limbo. Pueden aparecer como lesiones inmóviles y de consistencia firme, fijos a epiesclera o tejido escleral, indicando invasión. Asimismo, los OSSN palpebrales pueden aparecer como chalaziones o simular una blefaritis crónica.
No suelen asociarse a metástasis regionales ni a distancia. Son particularmente más agresivos en pacientes HIV y con xeroderma pigmentosum.
V. DIAGNÓSTICO
Es indudable que cada vez van tomando más peso aquellas pruebas no invasivas de resultado inmediato como la OCT en el manejo de la patología de la superficie ocular, aunque la inestimable ayuda que suponen nunca podrá sustituir a la evaluación clínica o el diagnóstico histopatológico.
El gold estándar del diagnóstico de OSSN sigue siendo la biopsia; bien incisional, mediante toma de pequeña porción del tumor, o excisional, extirpando la lesión visible completa. (1,7)
Histopatológicamente, la CIN se caracteriza por diferente grado de displasia celular, desde leve, moderada a severa; pero respetando la membrana basal, característico de cualquier carcinoma in situ. La sustancia propia no está afectada.
Las células presentan un elevado ratio nucleo/citoplásmico, falta de organización y anormal polaridad. Se pueden encontrar imágenes de mitosis a cualquier nivel del epitelio. Existe una brusca demarcación entre el epitelio displásico y el normal en los bordes de la lesión. Pueden presentarse como lesión pigmentada, simulando el melanoma, debido a la presencia intratumoral de melanocitos dendríticos. (1)
Cuando la membrana basal se ve afectada, se clasificaría como invasivo. También muestran células pleomórficas con disqueratosis, acantosis y falta de polaridad; asimismo, inmunohistoquímicamente son positivos al p53 y Ki-67. (2)
El Dr. Garcia de Oteyza, desde el Hospital de la Ceguera, México, indica en el Foro FacoElche que ellos realizan biopsia en lámpara de hendidura, y tras el resultado, inician terapia tópica.
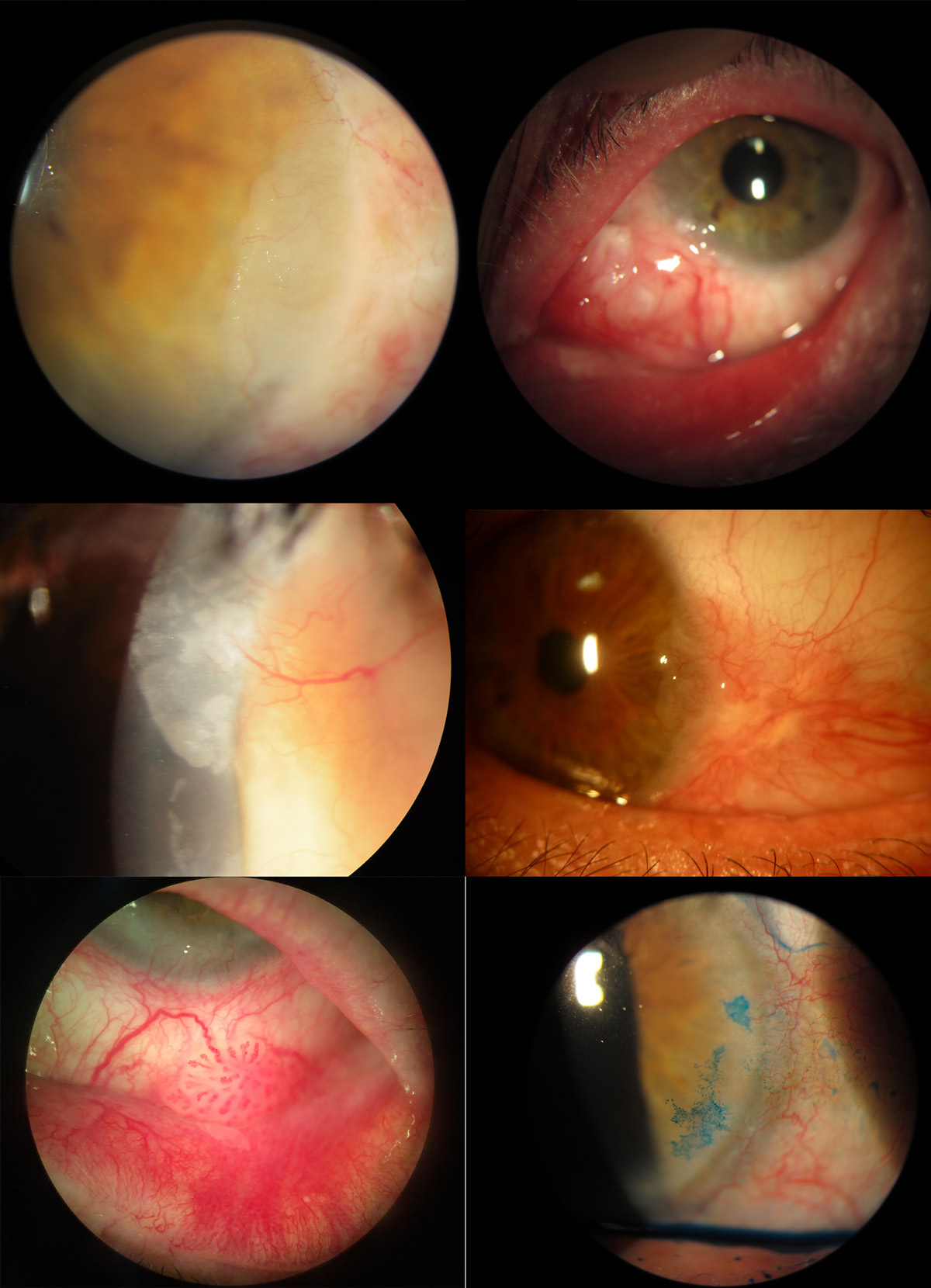
El examen clínico resulta sumamente valioso, especialmente cuando se tiene mucha experiencia en el seguimiento y terapia de OSSN. En la BMC, algunos cambios sugestivos de la transformación maligna son: configuración difusa o multifocal, pigmentación marronácea, diámetro medio basal mayor de 10 mm y espesor mayor de 1 mm. (2) (Figura 5)
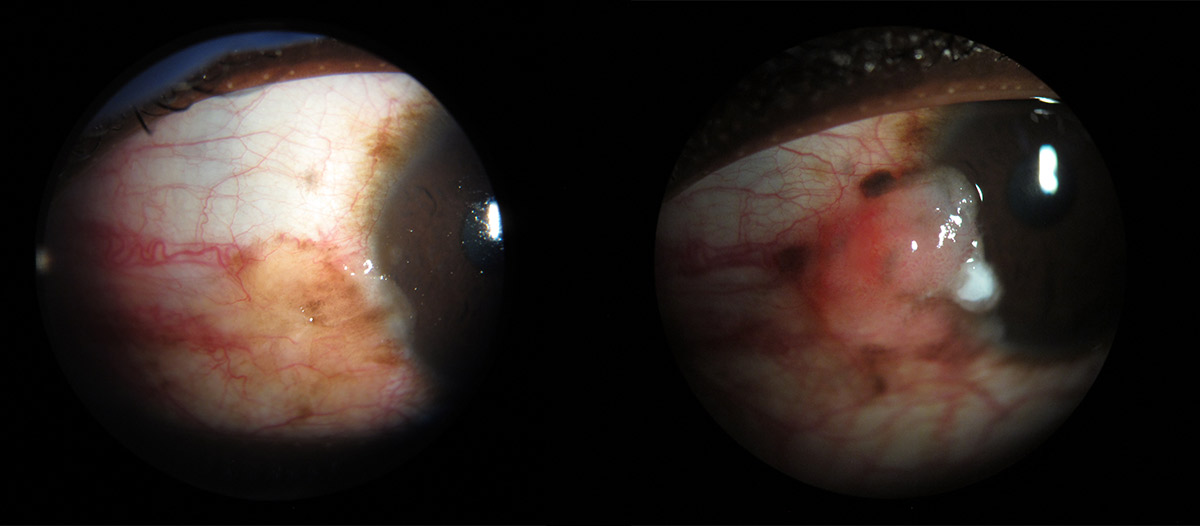
También nos podemos apoyar de otras pruebas complementarias que nos ayuden en el diagnóstico:
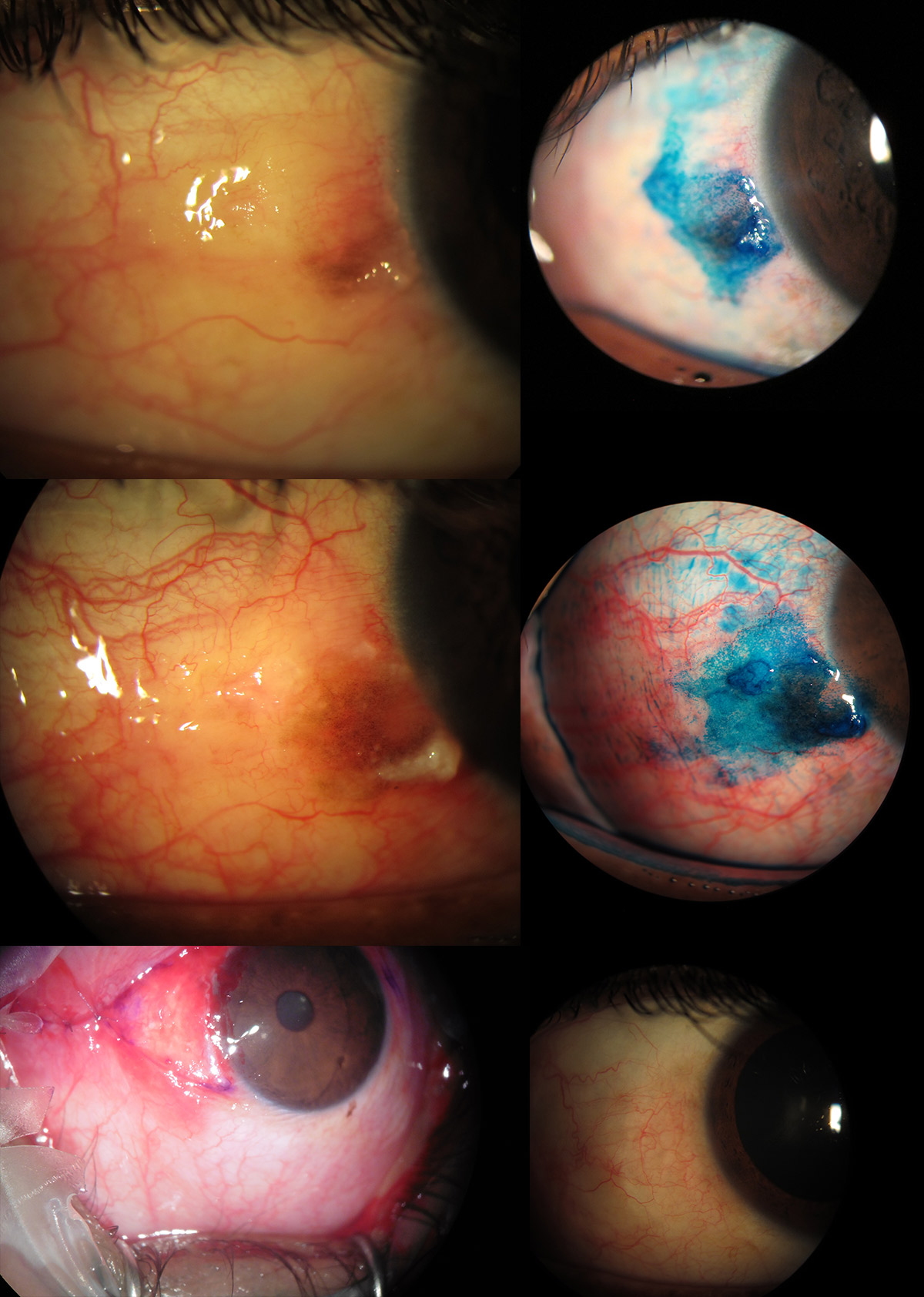
- Tinciones vitales: rosa de bengala, verde lisamina, azul de metileno, azul de toluidina.
Las tinciones, especialmente el verde lisamina, pueden ser útiles para detectar zonas de epitelio anómalo sospechoso de malignidad, especialmente si se rodea de epitelio normal. (Figura 6) Hay que tener en cuenta no son específicas de las OSSN, y otras patologías, como el ojo seco, muestran captación en la superficie ocular. (7)
- Citología de aspiración y de impresión, tienen la limitación de que son dependientes de la cantidad de células obtenidas, de la experiencia del citólogo que lo analiza. Y fundamentalmente que no permite la diferenciación entre enfermedad invasiva y no invasiva. (7)
- Microscopía Confocal: se han descrito ciertas características tumorales: como células pleomórficas hiperreflectivas, con grandes núcleos, con típico aspecto de “noche estrellada”. No obstante hay mucha variación en cuanto al grado de correlación de estas imágenes con la histopatología, además de ser muy dependiente de la experiencia del observador. (7)
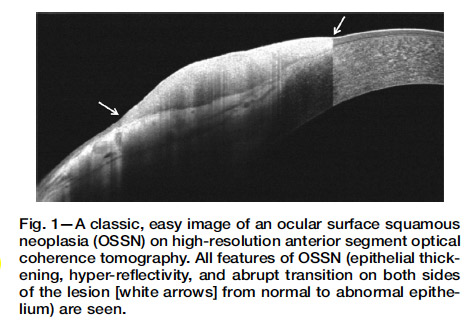
- OCT de segmento anterior: permiten obtener una imagen in vivo de la lesión. Con las nuevas OCT spectral domain de alta resolución (UHR–OCT) que permiten obtener un corte de hasta 2 micras, se han descrito características típicas de OSSN, pionera de esta técnica es la Doctora Carol Karp del Bascom Palmer. (Figura 7 , imagen incluida referencia numero 8)
- OSSN se caracteriza por una transición abrupta entre el epitelio normal y anormal, con un engrosamiento epitelial e hiperreflectividad del epitelio en el área del tumor. En varios artículos confirman una excelente correlación histopatológica de esta imagen y OSSN. (2,8,9,10,11,12,13)
- Nos ayuda en el diagnóstico diferencial con otras lesiones de la superficie ocular como: pterigion, degeneración nodular de Salzmann, melanomas amelanóticos, nevus conjuntivales… Todas estas lesiones se van a diferenciar del OSSN en que el epitelio va ser normal y la anomalía se va localizar subepitelialmente. También a la hora de diferenciar OSSN entre lesiones concomitantes de la superficie ocular. (11)
- Cada vez cobra más importancia de cara al diagnóstico pero también a la hora del seguimiento a nivel de detectar erradicación completa tumoral y de cara a detectar recurrencias de forma precoz.
- Como limitaciones mencionar que es una prueba que tampoco es capaz de definir el grado de invasión de la lesión. También en los casos de lesiones que hacen sombra y no permiten definir con nitidez la transición del epitelio normal al patológico. (8,9,10,11). Todavía está por definir el límite de micras de grosor para considerarlo como patológico, pues es muy variable en función del aparato, faltando más estudios al respecto. (se habla de límites en el grosor epitelial, siendo sospechoso de OSSN si supera 120-140 micras) (9)
- De cara a nuestro día a día, el gran hándicap estaría en que no todos disponemos de una UHR-OCT. No obstante, está descrita buena correlación con las imágenes obtenidas con OCT utilizadas en la clínica actualmente, especialmente RTVue (Optovue, Fremont, CA). Con una resolución transversal de 15 micras y resolución axial de 5 micras, parece una útil herramienta a la hora del diagnostico de OSSN (8,9)
VI. MANEJO Y TRATAMIENTO
OSSN es un tumor que puede ser localmente invasivo, aunque raramente produzca metástasis. Es importante completar una buena exploración oftalmológica que incluya eversión del párpado superior y palpación de nódulos linfáticos regionales; ya que ante cualquier evidencia de invasión intraocular u orbitaria, nos va modificar el manejo del mismo siendo preciso en estos casos la realización de enucleación o exenteración. (14)
Una vez tenemos el diagnóstico y extensión del OSSN hay varios factores que debemos de tener en cuenta antes de decidirnos por un tratamiento u otro.
OSSN pueden ser tratados eficazmente tanto de forma quirúrgica como médica o mediante una combinación de ambas. Los pacientes deben entender que se están sometiendo a un tratamiento de un tumor, y que es necesario un seguimiento largo.
La elección de una modalidad de tratamiento u otro dependerá de factores como la edad del paciente, comorbilidades, capacidad de cumplimiento del tratamiento, el tamaño y la localización del tumor.
El tratamiento tradicional de OSSN ha sido la cirugía con excisión con amplios márgenes y crioterapia. La cirugía solamente no parece suficiente para la prevención de las recurrencias que van de van desde el 33 % con márgenes negativos hasta un 56 % con márgenes positivos. (15) El Dr. Ulate, desde Costa Rica nos indicó en el Foro que su indicación habitual es la cirugía escisional, ya que resulta puede ser curativa y evita las molestias y riesgos derivados de la terapia local con quimioterápicos. Emplean biopsia incisional y quimioterapia tópica en los casos de tumores extensos que se muestran imposibles para escisión completa.
Ante la tasa de recurrencias y los efectos secundarios de la cirugía, hoy día hay una tendencia hacia los tratamientos conservadores (16) y el uso de quimioterápicos tópicos en el manejo de OSSN ha ido creciendo a lo largo de las dos últimas décadas.
VI. A – Manejo quirúrgico del OSSN
Técnica “no-touch” (14,16)
Desde que fuese descrito por Shields et al. esta técnica ha sido de elección en el manejo de los OSSN. Es llevada a cabo mediante una anestesia regional o general.
Bajo microscopía se delinea a 4 mm del margen de la lesión conjuntival. Hay que tener cuidado de no tocar directamente con ningún instrumento el tumor. Una vez delimitado se procede a la disección de la conjuntiva y Tenon. Normalmente en los OSSN limbares se comienza disecando la parte temporal dejando para el final la parte limbar. Si hubiese afectación escleral se completaría con una esclerectomía parcial.
Posteriormente la muestra se coloca en una cartulina donde se marcan las coordenadas. Se aplican a nivel de limbo dos esponjas quirúrgicas con alcohol absoluto durante 60 segundos. Si hay afectación corneal, se realiza un raspado del epitelio corneal hasta 3 mm desde el borde de la lesión tumoral, teniendo cuidado de no penetrar la membrana de Bowman. Si no hubiese afectación corneal, se realiza raspado de los 3 mm corneales adyacentes a la lesión conjuntival.
Se aplica crioterapia en los bordes de lesión usando la técnica de doble congelación-descongelación. Se aplica hasta que la conjuntiva se congele y se vuelva blanquecina.
Hay que levantar un poco la conjuntiva con la sonda para no tocar esclera, pisar el pedal hasta que la conjuntiva blanquee, soltar el pedal entonces, dejar que se descongele y con la sonda en la misma posición se repite el mismo procedimiento. Repetir el procedimiento las dos veces rodeando todos los márgenes incluyendo el limbo.
El cierre de la herida se puede realizar movilizando la conjuntiva adyacente o bien, con trasplante de membrana amniótica.
Como tratamiento suplementario intraoperatorio, se puede utilizar la mitomicina C aplicada al 0.02-0.04% en la conjuntiva y esclera durante 3-4 minutos. No obstante, no hay estudios randomizados que avalen sus resultados por lo que dado los riesgos de escleromalacia por la MC, generalmente se reserva para tumores grandes, recurrentes y avanzados y donde se sospeche la presencia de una neoplasia no escamosa.
Complicaciones de la cirugía
Las complicaciones de la cirugía comprenden infección por falta de epitelización, deficiencia de células limbares tras una excisión amplia, simbléfaron, estrabismo restrictivo, ojo seco etc.
Se han reportado complicaciones relacionadas con la crioterapia como hipema, probablemente por la hemorragia de los vasos en la raíz del iris y corectopia por sinequias anteriores e iridociclitis. (14,17)
VI. B – Manejo con tratamiento tópico (21,22)
Se ha descrito su uso como terapia única sin cirugía, o como tratamiento coadyuvante al procedimiento quirúrgico, pre, intra o postoperatoriamente.
El objetivo de la cirugía en OSSN es obtener márgenes libres de tumor mientras se preserva la mayor cantidad de tejido sano. Pero en casos de tumoraciones extensas (donde el riesgo de una deficiencia limbar posterior es elevado), multifocales y/o recurrentes, el tratamiento médico parece ser mejor opción.
Se ha hablado de Interferón tópico como primera opción a dosis de 1 millon de IU/ mL 4 veces al día durante 2 meses, con buena tolerancia. (19) Nanji AA et al. (17) comparan 49 casos tratados con Interferón alfa frente a 49 tratados con cirugía exclusivamente y no encontraron diferencias estadísticamente significativas en cuanto al ratio de recurrencia entre los dos grupos. Señalan que la quimioterapia tópica es igual de eficaz en el tratamiento de lesiones primarias, obteniéndose tasas similares de recurrencia que con la cirugía.
El tratamiento tópico adyuvante en el postoperatorio, tiene como objetivo eliminar cualquier célula tumoral residual y así reducir la tasa de recurrencia. Se ha observado que en aquellos casos de resección con márgenes positivos, el uso tópico de interferón durante 2 meses disminuyó el riesgo de recidiva a cifras iguales a márgenes negativos. (19) Osea, que generalmente se realiza tratamiento coadyuvante para aquellos casos de alto riesgo de recurrencia: márgenes quirúrgicos positivos, recurrencia previa, localización de alto riesgo (por ejemplo conjuntiva tarsal).
Ventajas:
El tratamiento médico tiene las ventajas frente al tratamiento quirúrgico en que puede tratar la totalidad de la superficie ocular, ya sea enfermedad microscópica o subclínica. Está exento del riesgo de infección o de cicatrización. Sin embargo, el éxito de recae sobre la cooperación del paciente. La capacidad de aplicarse correctamente las gotas, el cumplimiento de la pauta así como las visitas.
Inconvenientes:
No existen especialidades farmacéuticas comercializadas como colirios, por lo que estos se preparan por Formulación Magistral tanto en farmacia de hospital como en farmacia comunitaria. En US, no están cubiertos por las aseguradoras médicas, por lo que el factor económico también es, en su caso, un factor decisivo a la hora de decantarse por un tratamiento u otro.
Las opciones empleadas hasta la fecha han sido la Mitomicina C, el 5 Fluoracilo y el Interferón. No existen estudios comparativos entre ellas.
Mitomicina C (la gota del diablo “the devil drop”, Carol Karp) (20)
- Agente alquilante, inhibe la síntesis de DNA
- Se emplea a concentraciones 0.02%-0.04 %
- Dosis: 4 veces al día durante 7 días y 2-3 semanas de descanso. El Dr. Polit, en el Foro de FacoElche indica sus buenos resultados a lo largo de 20 años de con Mitomicina 0.25 mgr/ml x3 durante un mes, aunque actualmente ha rebajado la dosis a 0.20mgr/ml 2 semanas, repitiendo si es necesario. El indica que no realiza biopsia basando su diagnóstico en la exploración clínica.
- Normalmente requiere 3 ciclos para su resolución
- Precio en USA 300$ / bote, aproximadamente. Necesita refrigeración
- Reacciones adversas: dolor, conjuntivitis, queratitis, epiteliotóxico, deficiencia de células limbares, estenosis de puntos lagrimales
- Precisa implantar tapones lagrimales , tratamiento corticoideo y lágrimas
- Eficacia del 75-100 %
- Recurrencia 0-35 %
5 Fluoracilo (“assistant devil drop”) (20)
- Citostático con acción antimetabolito
- Se emplea a concentración de 1%
- Dosis 4 veces al día durante 7 días y descanso de 3 semanas. 1 semana “on” y 3 semanas “off”
- Normalmente 3-4 ciclos. En el Hospital de la Ceguera, tras un primer ciclo evalúan la respuesta y si no es completa lo repiten. Indican casos de resolución con un solo ciclo. El Dr. Martinez Osorio, desde Arabia (donde la OSSN parece ser más frecuente y refractaria), comunica en el Foro de Facoelche sus buenos resultados en terapia con 5FU 1% x4 2 semanas on y 2 semanas off, con respuesta favorable tras 3 ciclos en pacientes aún con 2/3 de limbo afectados.
- Eficacia 85%
- Recurrencia 12.5-43 %
- Más barata y estable que MMC. En USA 37 $/ ciclo y 75 $ el bote (dura 2 ciclos), aproximadamente. No necesario refrigeración.
- Reacciones adversas: menos dolor que MMC, hiperemia conjuntival. Descrito estenosis del punto lagrimal en tratamiento sistémico. No descrito en tratamiento tópico.
- Puede ser necesario tratamiento corticoideo y lágrimas adyuvantes.
- De elección en casos de no respuesta o respuesta incompleta a IFN, si hay menos recursos económicos o si el paciente lo prefiere por comodidad de posología.(22,24)
Interferón alfa 2b (“angel drop” “flu shot”) (15)
- IFN alfa es una citoquina con múltiples funciones inmunomoduladoras.
- Tópica : 1 millón IU / ml 4 veces al día de forma continuada hasta resolución ( normalmente 4 meses) ( descrito similar eficacia ya sea a concentración de 1 MIU que 3 MIU)
- Subconjuntival: 3 millones IU/ 0.5ML semanalmente hasta resolución (4-5 inyecciones) Vial comercializado de 18 MIU. El Dr. Martinez Osorio indica buenos resultados en casos de compromiso bulbar extenso, con inyección mensual de 5 millones de unidades.
- Eficacia 76-100% de casos
- Recurrencia 20 %
- Reacción adversas escasas, muy bien tolerada, puede dar conjuntivitis folicular y síntomas gripales tras inyección.
- Descrito falta de respuesta en pacientes con inmunosupresión. La presencia o no del HPV no tiene efecto en la respuesta al IFN. (22)
- Precio aproximado en USA 500$ / mes hasta resolución. Necesita refrigeración. (23)
Conclusiones en cuanto al manejo de OSSN
- La Biopsia incisional estaría indicada en lesiones muy grandes en zonas quirúrgicamente complicadas, sobre todo cuando implican tratamientos más agresivos como enucleación / exanteración.
- En lesiones pequeñas con baja sospecha, la biopsia escisional con bordes amplios y autoinjerto podría ser suficiente, si bien, si en histopatología aparecen los bordes afectados, sería necesario tratamiento adyuvante tópico añadido.
- En lesiones con alta sospecha de malignidad, técnica no touch + pensar en tratamiento adyuvante.
- El tratamiento médico es una opción válida, pero hay que tener en cuenta que podría necesitar 4 meses en resolverse, factor a contemplar de cara al perfil del paciente para el cumplimiento del tratamiento y seguimiento posterior. (20,25)
- Aunque la primera elección sea IFN, por su buena respuesta y tolerabilidad; el 5 FU, ha mostrado una eficacia similar al IFN, más económica, con mejor tolerabilidad y menos efectos adversos que la MMC. El 5 FU ha sido la opción más recomendada en el Foro de Facoelche.
Aunque hasta ahora la cirugía ha sido el tratamiento de elección de las OSSN, deberíamos tener en mente las posibilidades de tratamiento tópico como terapia única o adyuvante a la cirugía e individualizar en cada paciente la opción más conveniente.
BIBLIOGRAFÍA
- Mannis MJ, Holland EJ. Cornea. Fundamentals, diagnosis and management. In: Warner MA, Stagner AM, Jakobiec FA. Epithelial tumors of the conjunctiva. 4th ed. Elsevier; 2017:410-426.
- Cicinelli MV, Marchese A, Bandello F, Modorati G. Clinical Management of Ocular Surface Squamous Neoplasia: A Review of the Current Evidence. Ophthalmol Ther. 2018 Jul 20.
- Shields CL, Chien JL, Surakiatchanukul T, Sioufi K, Lally SE, Shields JA. Conjunctival Tumors: Review of Clinical Features, Risks, Biomarkers, and Outcomes–The 2017 J. Donald M. Gass Lecture. Asia Pac J Ophthalmol (Phila). 2017 Mar-Apr; 6(2):109-120.
- Lee GA, Hirst LW. Incidence of ocular surface epithelial dysplasia in metropolitan Brisbane. A 10-year survey. Arch Ophthalmol. 1992 Apr; 110(4):525-7.
- Oellers P, Karp CL, Sheth A, Kao AA, Abdelaziz A, Matthews JL, Dubovy SR, Galor A. Prevalence, treatment, and outcomes of coexistent ocular surface squamous neoplasia and pterygium. Ophthalmology. 2013 Mar; 120(3):445-450.
- Shields CL, Ramasubramanian A, Mellen PL, Shields JA. Conjunctival squamous cell carcinoma arising in immunosuppressed patients (organ transplant, human immunodeficiency virus infection). 2011 Nov; 118(11):2133-2137.
- Nanji AA, Mercado C, Galor A, Dubovy S, Karp CL. Updates in Ocular Surface Tumor Diagnostics. Int Ophthalmol Clin. 2017 summer; 57(3):47-62.
- Yim M, Galor A, Nanji A, Joag M, Palioura S, Feuer W, Karp CL. Ability of novice clinicians to interpret high-resolution optical coherence tomography for ocular surface lesions. Can J Ophthalmol. 2018 Apr; 53(2):150-154.
- Nanji AA, Sayyad FE, Galor A, Dubovy S, Karp CL. High-Resolution Optical Coherence Tomography as an Adjunctive Tool in the Diagnosis of Corneal and Conjunctival Pathology. Ocul Surf. 2015 Jul; 13(3):226-35.
- Thomas BJ, Galor A, Nanji AA, El Sayyad F, Wang J, Dubovy SR, Joag MG, Karp CL. Ultra high-resolution anterior segment optical coherence tomography in the diagnosis and management of ocular surface squamous neoplasia. Ocul Surf. 2014 Jan; 12(1):46-58.
- Shousha MA, Karp CL, Canto AP, Hodson K, Oellers P, Kao AA, Bielory B, Matthews J, Dubovy SR, Perez VL, Wang J. Diagnosis of ocular surface lesions using ultra-high-resolution optical coherence tomography. 2013 May; 120(5):883-91.
- Atallah M, Joag M, Galor A, Amescua G, Nanji A, Wang J, Perez VL, Dubovy S, Karp CL. Role of high resolution optical coherence tomography in diagnosing ocular surface squamous neoplasia with coexisting ocular surface diseases. Ocul Surf. 2017 Oct; 15(4):688-695.
- Shousha MA, Karp CL, Canto AP, Hodson K, Oellers P, Kao AA, Bielory B, Matthews J, Dubovy SR, Perez VL, Wang J. Diagnosis of ocular surface lesions using ultra-high-resolution optical coherence tomography. 2013 May; 120(5):883-91.
- Mannis MJ, Holland EJ. Cornea. Fundamentals, diagnosis and management. In: Sivaraman KR, Karp CL.Medical and surgical management of ocular squamous neoplasia. 4th ed. Elsevier; 2017:427-433.
- Siedlecki AN, Tapp S, Tosteson AN, Larson RJ, Karp CL, Lietman T, Zegans ME. Surgery versus Interferon Alpha-2b Treatment Strategies for Ocular Surface Squamous Neoplasia: A Literature-Based Decision Analysis. 2016 May; 35(5):613-8.
- Shields JA, Shields CL, De PotterP. Surgical management of conjunctival tumors. The 1994 Lynn B. MacMahan Lecture. Arch Ophthalmol 1997; 115:808-15.
- Nanji AA, Moon CS, Galor A, Sein J, Oellers P, Karp CL. Surgical versus medical treatment of ocular surface squamous neoplasia: a comparison of recurrences and complications. Ophthalmology. 2014 May; 121(5):994-1000.
- Galor A, Karp CL, Oellers P, Kao AA, Abdelaziz A, Feuer W, Dubovy SR. Predictors of ocular surface squamous neoplasia recurrence after excisional surgery. Ophthalmology. 2012 Oct;119(10):1
- Nanji AA, Sayyad FE, Karp CL. Topical chemotherapy for ocular surface squamous neoplasia. Curr Opin Ophthalmol. 2013 Jul; 24(4):336-42.
- Sayed-Ahmed IO, Palioura S, Galor A, Karp CL. Diagnosis and Medical Management of Ocular Surface Squamous Neoplasia. Expert Rev Ophthalmol. 2017;12(1):11-19
- Joag MG, Sise A, Murillo JC, Sayed-Ahmed IO, Wong JR, Mercado C, Galor A, Karp CL. Topical 5-Fluorouracil 1% as Primary Treatment for Ocular Surface Squamous Neoplasia. Ophthalmology. 2016 Jul;123(7):1442-8
- Ashkenazy N, Karp CL, Wang G, Acosta CM, Galor A. Immunosuppression as a Possible Risk Factor for Interferon Nonresponse in Ocular Surface Squamous Neoplasia. 2017 Apr; 36(4):506-510.
- Moon CS, Nanji AA, Galor A, McCollister KE, Karp CL. Surgical versus Medical Treatment of Ocular Surface Squamous Neoplasia: A Cost Comparison. Ophthalmology. 2016 Mar;123(3):497-504
- Galor A, Garg N, Nanji A, Joag M, Nuovo G, Palioura S, Wang G, Karp CL. Human Papilloma Virus Infection Does Not Predict Response to Interferon Therapy in Ocular Surface Squamous Neoplasia. Ophthalmology. 2015 Nov; 122(11):2210-5.
- Mercado CL, Pole C, Wong J, Batlle JF, Roque F, Shaikh N, Murillo JC, Galor A, Karp CL. Surgical versus medical treatment for ocular surface squamous neoplasia: A quality of life comparison. Ocul Surf. 2018 Sep 11.
- Rodríguez-Ausín P, Hita-Antón C, Míguez-Garcia C, Antolín-Garcia D, Suárez-Aguado J. A new oct sign of invasive squamous cell carcinoma of the cornea. Arch Soc Esp Oftalmol. 2016 Feb;91(2):90-3
AUTOR

Dra. Naon Kim
Adjunto de superficie ocular y córnea
Hospital Universitario Torrejón
Bajo supervisión de:
Dra. Paz Rodríguez Ausín
Jefe de Servicio de Oftalmología
Hospital Universitario Torrejón