Caso clínico y propuestas del Foro
En el Foro FacoElche, y por parte del Dr. Patricio Navarro, se inició un hilo acerca de un caso de Endoftalmitis crónica en un paciente de 70 años con cirugía previa de cataratas con implante de LIO en 2016, y donde surgió cierta controversia sobre cómo manejar este tipo de complicaciones.
El paciente sufre el primer episodio de inflamación en el segmento anterior dos años después de la cirugía, seguido de otros dos episodios en un periodo de cuatro meses que responden bien al tratamiento con corticoides tópicos. El tercer episodio es de mayor intensidad, con edema macular cistoide (EMC) que justifica disminución de la visión, por lo que se toman muestras de humor acuoso para cultivo y estudio de PCR, resultando ambos positivos para Propionibacterium acnes.
Se realiza tratamiento con Claritromicina oral durante 30 días, y corticoides tópicos con mejoría. Dos meses después se produce una nueva recidiva con aumento del EMC y mayor pérdida de visión por lo que se propone al paciente explante de la LIO y lavado de la cámara anterior con antibióticos, a lo que se niega por su relativa buena visión (20/25) y pocas molestias. El Dr. Navarro deja el caso abierto a las opiniones de los compañeros del Foro acerca del manejo de esta patología.
El Dr. Uchiyama propone como tratamiento realizar una vitrectomía vía pars plana, capsulectomía “agresiva”, e inyección de vancomicina intravítrea. El Dr. Batlle es de la misma opinión y hace referencia al trabajo de Fox et al (AJO, 1991). El Dr. Gegúndez propone explante de la LIO, lavado y limpieza profusa del saco capsular con BSS (500 ml con adición de 10 mg de vancomicina), implantación de una nueva LIO, inyección de moxifloxacino 0.5% en cámara anterior. El Dr. Cordovés comenta que inicialmente se podría intentar hacer un tratamiento con Claritromicina oral (500 mg 2 veces al día, mantenido durante 15 días – 1 mes) y asociarle un lavado del saco capsular con solución de vancomicina; de no responder se procedería a un tratamiento más agresivo ya propuesto por el Dr. Uchiyama. El Dr. Abreu sugiere para casos de larga evolución con EMC e importante repercusión funcional, una actuación con fines diagnósticos utilizando el vítreo como caldo de cultivo, y terapéutico sin extracción de la LIO, a realizar de manera secuencial en dos días; primer día, capsulotomía amplia con láser YAG realizada en la consulta; segundo día, cirugía realizada por un facultativo de la sección de vítreo-retina consistente en vitrectomía, ampliar lo “máximo” la capsulotomía previa, con toma de muestras para tinción Gram, siembra directa en placas para cultivos de bacterias y hongos, y muestra para PCR; al finalizar Vancomicina 1 mg/0.1 ml intravítrea. En la discusión también participa el Dr. Pellegrino comentando que, en varias ocasiones, cuando no disponía de PCR, tuvo pacientes como el que comenta el Dr. Navarro en los que inicialmente sospechó la presencia de Propionibacterium acnes y en realidad eran endoftalmitis fúngicas. Hace hincapié en la necesidad de realizar sin demora un tratamiento eficaz para conservar la mejor función visual y prevenir la poco probable, pero posible, evolución hacia la “ptisis bulbi” (Pellegrino FA y cols. Arch Soc Esp Oftalmol. 2005).
Dr. Fernando Soler
Introducción
La endoftalmitis postquirúrgica “crónica” tras la cirugía extracapsular de la catarata fue descrita por primera vez en 1986 por Meisler y cols.(1). En la literatura ha recibido diferentes denominaciones: “endoftalmitis localizada”(2), “endoftalmitis tórpida”(3), “endoftalmitis de comienzo tardío”(4), “endoftalmitis de bajo grado”(5) etc., dando lugar a confusión entre los lectores, por lo que nosotros propusimos en 1992 el nombre de “endoftalmitis sacular”(6) dado que la aparición de esta situación clínica en la cirugía de la catarata tiene como requisito la presencia del saco capsular, lugar de acantonamiento de los gérmenes. El convencimiento de que unificar la denominación tenía ventajas hizo que insistiéramos en esa idea(7), utilizándose dicho término en algunas publicaciones(8, 9, 10). En estas páginas hablaremos de endoftalmitis “crónicas” por ser la primera denominación y la mayoritariamente utilizada.
La endoftalmitis crónica es una rara complicación de la cirugía de la catarata que puede ocurrir meses o incluso años después de la misma(11), teniendo una incidencia del 0.02-0.05%(12), inferior a la endoftalmitis aguda, pero que es necesario tenerla en consideración en todos los cuadros inflamatorios de aparición tardía. Esta plantea dificultades diagnósticas y terapéuticas, siendo prioritaria la confirmación etiológica(13).
Etiología
Los microorganismos más frecuentes en la endoftalmitis crónica están habitualmente presentes en la flora saprofítica de la conjuntiva y anejos oculares (gérmenes de baja virulencia y hongos)(4), siendo un pequeño porcentaje las infecciones mixtas:
- Propionibacterium acnes
- Staphylococcus epidermidis
- Candida parapsilosis
- Corynebacterium spp.
- Streptococcus spp.
- Actynomices israelli
- Nocardia asteroides
- Alcaligenes xylosoxidans
El Propionibacterium acnes, principal agente de las endoftalmitis postquirúrgicas crónicas, es un bacilo Gram-positivo, no esporulado, pleomórfico, de crecimiento relativamente lento, anaerobio estricto, aunque se cree que posee aerotolerancia, forma parte del microbiota normal de la piel.
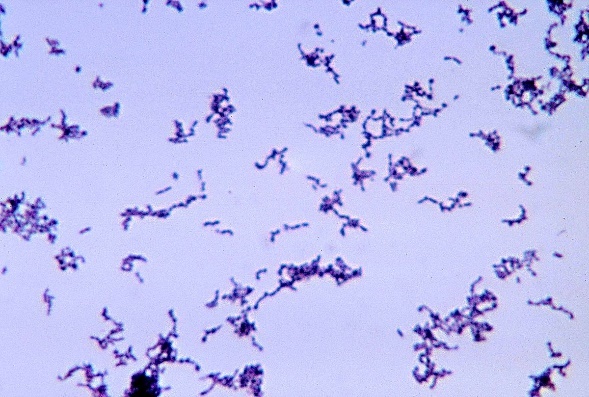
Se han publicado pocos casos de microorganismos virulentos como causa de endoftalmitis crónicas(14), pudiendo ser debido ello al insuficiente tratamiento con antibióticos y corticoides de una endoftalmitis infecciosa aguda(15). También se han reportado casos debidos a Escherichia fergusonii(16).
La etiología fúngica es poco frecuente. Las especies más implicadas halladas en cultivos son los Aspergillus y Fusarium; en pacientes tanto inmunocompetentes como inmunodeprimidos se ha observado la presencia de Massilia timonae(17), y especialmente en inmunodeprimidos de Penicillium citrinum(18).
Clínica
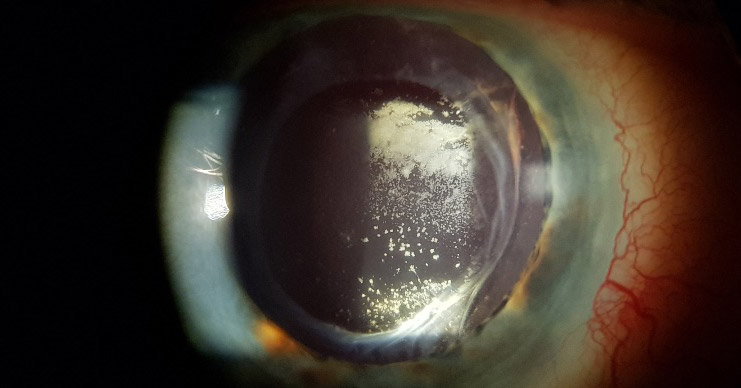
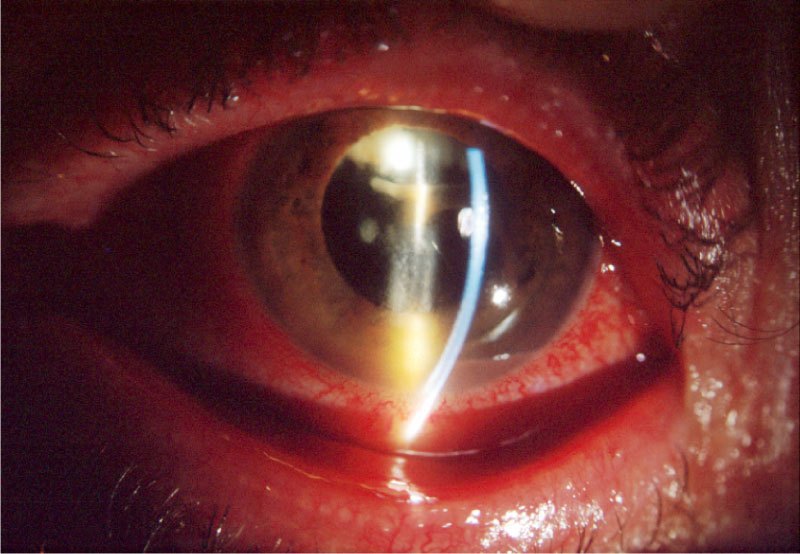
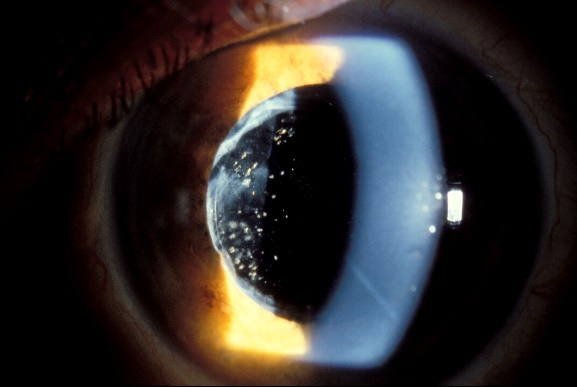
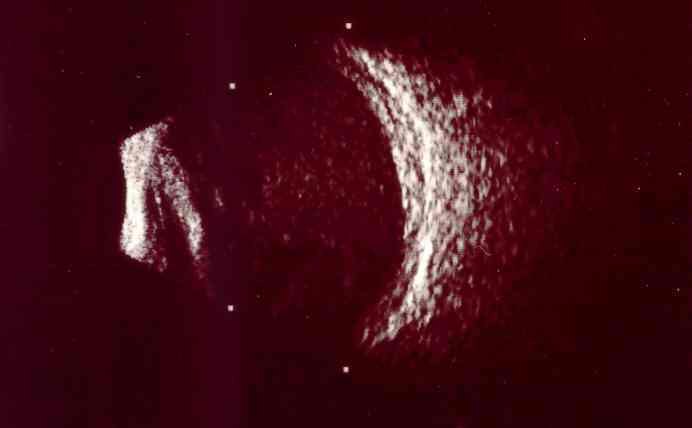
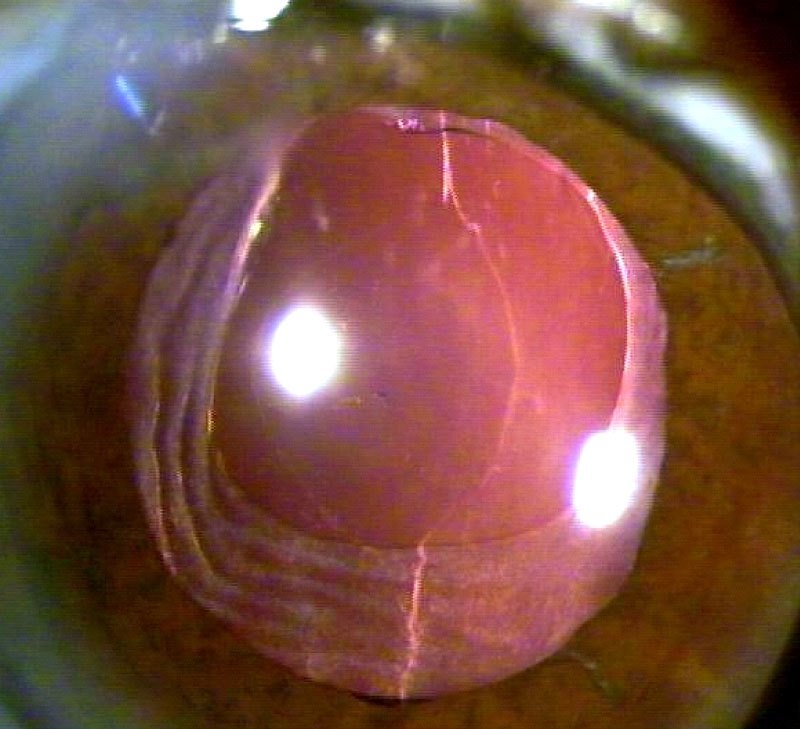
Su curso clínico insidioso(1, 19) está relacionado probablemente con la baja virulencia de los microorganismos implicados. Tras un postoperatorio sin incidencias se inicia un síndrome inflamatorio de predominio en el segmento anterior que aparece como una iridociclitis granulomatosa de instauración progresiva, evolucionando de forma crónica y recurrente en relación con el uso de corticoides. Se acompaña de disminución de la agudeza visual en principio leve, y que empeora progresivamente en relación con las recurrencias, escaso o nulo dolor, enrojecimiento y fotofobia. Un signo clásico, que puede o no estar presente, es la existencia de placas blanquecinas de diferente morfología en el saco capsular o sobre la LIO (material residual del cristalino, colonias bacterianas, biofilm)(1, 20–22) (fig. 2, fig. 3). De manera poco frecuente, el paciente puede presentar una reacción inflamatoria importante en la cámara anterior, con la aparición de precipitados en la córnea además de hipopion. La presencia de vitrítis en menor o mayor grado nos puede orientar sobre el pronóstico: una ecografía en modo B está indicada (fig. 4).
La etiología fúngica hay que sospecharla ante la aparición progresiva de infiltrados blanquecinos en la cavidad vítrea anterior, cerca del complejo capsular, en forma de “collar de perlas”. El dolor suele ser moderado o inexistente, y la visión tan sólo se ve afectada discretamente(23).
Diagnóstico
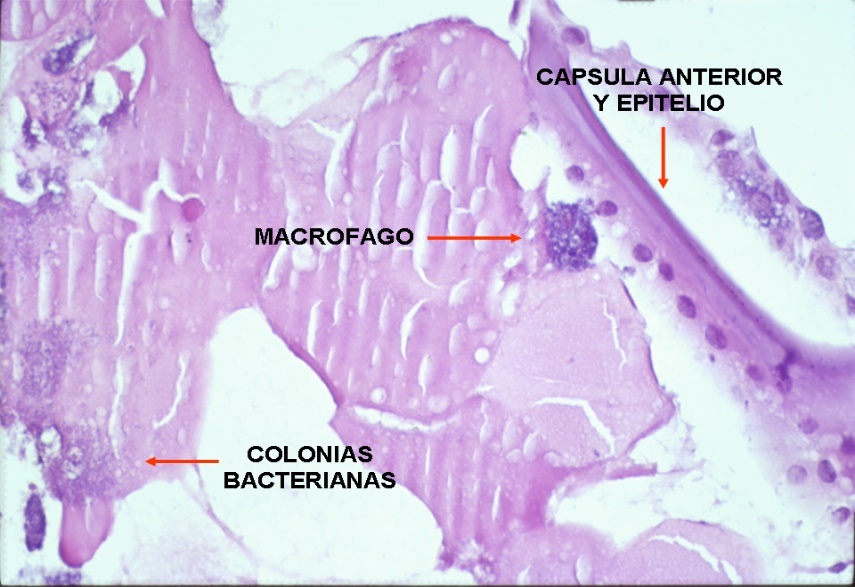
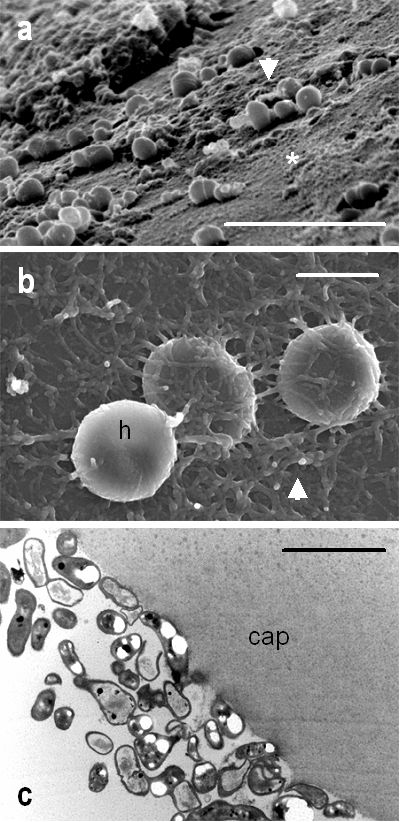
Se basa en las tinciones, cultivos, estudios histopatológicos y técnicas de biología molecular (reacción en cadena de la polimerasa). Hay que tener en cuenta que las bacterias anaerobias son delicadas y deben ser de inmediato inoculadas en caldo de cultivo para evitar con la manipulación que se altere la muestra o una posible contaminación. Para confirmar el diagnóstico lo ideal sería disponer de muestras de humor acuoso, humor vítreo y saco capsular, para cultivos (aerobios, anaerobios y hongos), PCR, y estudios citológicos e histopatológicos(7) (fig. 5). La microscopía electrónica de barrido y de transmisión, de poder disponer de la misma, permite obtener imágenes directas del biofilm bacteriano y microorganismos que nos ayudan a la confirmación del diagnóstico(24) (fig. 6). A pesar de ello, en la práctica el primer paso suele ser la toma de una muestra de humor acuoso (principalmente para PCR), que en un importante porcentaje de casos evitará intervenciones más agresivas, tal y como se comenta más adelante en el apartado de tratamiento.
Los cultivos de muestras de humor acuoso y de humor vítreo son la mayoría de las veces negativos(18), debiéndose mantener los mismos un mínimo de catorce días debido a que el Propionibacterium acnes comienza a crecer a partir del séptimo día. Actualmente se propone como prueba diagnóstica de elección el estudio mediante PCR(25), especialmente en los casos de posible etiología múltiple(26).
El diagnóstico diferencial debe realizarse en primer lugar con la uveítis facoanafiláctica, aunque se ha sugerido que ambos cuadros son la misma entidad o que concurren ambas circunstancias siendo la respuesta inmune producida consecuencia de la interacción entre las bacterias y el material cristaliniano residual. Es importante diferenciar entre causa infecciosa y una causa estéril (excesiva manipulación quirúrgica, síndrome tóxico de la LIO, etc.). Sólo la identificación del germen causal conducirá al diagnóstico(1).
Reacción en cadena de la polimerasa (PCR)
Técnica
La PCR es un procedimiento de biología molecular que permite obtener cantidades detectables de DNA a partir de una mínima cantidad presente en la muestra inicial (0,05 ml, 2 gotas). Por ello es de gran interés para el estudio de las infecciones oculares, donde la cantidad del agente patógeno que recogemos es muy pequeña y, como hemos comentado, a menudo los cultivos son negativos.
Para poder realizar la PCR tenemos que conocer la secuencia de algún fragmento del DNA que vamos a amplificar, para usar los cebadores complementarios de esos fragmentos. Afortunadamente, la mayoría de bacterias comparten secuencias conservadas de su 16S DNA/RNA ribosómico, lo que nos permite usar cebadores dirigidos a las mismas y amplificar el DNA de prácticamente cualquier bacteria presente en la muestra(27). En el caso de que el agente causal fuese un hongo, también se han desarrollado cebadores específicos para ellos(28, 29, 30, 31).
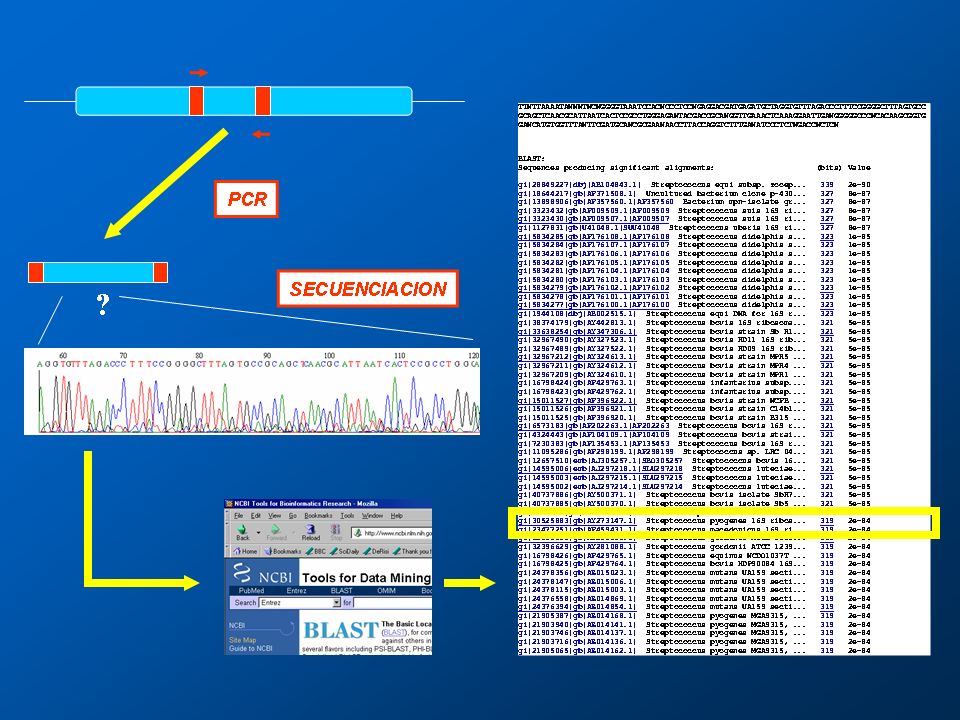
Una vez que tenemos una cantidad detectable del DNA del patógeno, hay que identificarlo, y eso se puede lograr mediante diferentes métodos. Uno consiste en digerir el producto de la PCR mediante endonucleasas de restricción y observar el patrón obtenido(32) (técnica de “huella dactilar”). Otro es utilizar técnicas de hibridación con DNAs marcados(33), que sólo se unirán al producto correcto. También se pueden utilizar la PCR con cebadores dirigidos a secuencias más específicas de cada bacteria o agente infeccioso. Por último, la técnica más precisa de identificación, pero también la más costosa y laboriosa, consiste en la secuenciación del DNA producido, para después compararlo mediante el programa BLAST con la base de datos del GenBank del Instituto Nacional de la salud de Estados Unidos (disponible http://www.ncbi.nlm.nih.gov)(34) (fig. 7).
Una de las ventajas de la PCR es su altísima sensibilidad, ya que puede detectar cantidades mínimas del DNA del agente patógeno. Pero ello también conlleva limitaciones, ya que la contaminación durante la toma de muestras o en el laboratorio puede ocurrir fácilmente, siendo importante realizar controles negativos para asegurar la fiabilidad de la técnica. Una de las fuentes de error puede ser la contaminación de la DNA polimerasa utilizada, por lo que se suele someter a tratamientos previos para evitar falsos positivos(35).
Uso en endoftalmitis crónicas
Es en el estudio de las endoftalmitis crónicas donde primero nos encontramos una referencia al uso de la PCR en endoftalmitis(36). En este tipo de endoftalmitis, la ventaja de la PCR frente al cultivo es todavía mayor que en las agudas, puesto que los cultivos son más frecuentemente negativos (la carga bacteriana es baja, son bacterias de crecimiento lento y a menudo se localizan en el interior de los macrófagos). En un reciente estudio de Lohmann y cols.(37) en una serie de 25 pacientes con el diagnóstico clínico de endoftalmitis crónica, el cultivo de humor acuoso dio positivo en un 0% frente a un 84% con PCR y el cultivo vítreo dio positivo en un 24% frente a un 92% con PCR. Si sumamos a este hecho el que en las endoftalmitis crónicas no se requiere una intervención tan inmediata como en las agudas, al tratarse de procesos de evolución más lenta, se deduce que la PCR puede jugar un papel muy importante al permitirnos confirmar la etiología infecciosa del cuadro e incluso, etiquetar el agente causal antes de actuar (se puede realizar una paracentesis de cámara anterior y tomar una muestra para PCR previamente a realizar una vitrectomía u otra intervención más agresiva)(38).
Si no se dispone de un laboratorio que realice la PCR a nivel local, actualmente se acepta que la muestra se puede conservar a + 4ºC un máximo de 24 horas y mandarla por mensajería a temperatura ambiente para que sea recibida por el laboratorio de referencia al día siguiente. En el caso de tener que mantener la muestra durante más tiempo se debe congelar a -20ºC(39).
Como conclusión decir que la técnica de la PCR tiene un gran potencial para el manejo clínico de las infecciones oculares, pero es necesaria la estandarización entre los laboratorios que la realicen, para evitar los errores inherentes a una técnica tan sensible, y poder obtener resultados comparables que sean aplicables en cada paciente individualmente.
Endoftalmitis crónicas y biofilm
Los gérmenes productores de biofilm generan una malla o escudo de protección constituida por exopolisacáridos, lipopolisacáridos, proteínas y ácidos nucleicos que actúan como barrera física al prevenir la entrada de antibióticos y mantener a las bacterias aisladas de las defensas del huésped(40). El secuestro del agente patógeno en el saco capsular y la formación de biopelículas en la superficie de las LIO implantadas se consideran los responsables de los episodios recurrentes de inflamación, y de la respuesta insuficiente a los agentes antimicrobianos empleados, aun siendo utilizados de forma intravítrea(41).
La terapéutica antibiofilm en oftalmología está en pleno desarrollo. La inhibición de la formación del mismo ha sido descrita asociada al uso de Claritromicina(42). Sin embargo, existen dos sustancias que se utilizan de forma habitual en la práctica oftalmológica y han demostrado al menos in vitro acción antibiofilm: el cloruro de benzalconio y el Ketorolaco(43).
Hoy sabemos que la producción de biofilm no solo compete a prácticamente todo el universo bacteriano, sino también a las formas fúngicas. Desconocer el biofilm es en síntesis desconocer al enemigo involucrado en las endoftalmitis(44).
Tratamiento
Se han sugerido diferentes tratamientos conservadores teniendo en cuenta la sensibilidad del Propionibacterium acnes, Staphylococcus epidermidis y Corynebacterium spp., como la irrigación del saco capsular con Clindamicina e inyección de oxígeno al 100% en cámara anterior(45), administración de Vancomicina 1mg/0,1 ml intravítrea después de la toma de muestras(22), etc. La inyección de antibióticos intravítreos puede no ser suficiente debido al acantonamiento de los gérmenes en el saco capsular, el hecho de que estos puedan permanecer aislados intracelularmente en polimorfonucleares y macrófagos, y la presencia de biofilm(46). Este hecho de que los gérmenes permanezcan dentro de las células fagocíticas ya fue sugerido por Meisler(01). Fue a partir de la observación en una muestra de uno de nuestros pacientes (fig. 5), cuando el grupo del Dr. David Seal propone el empleo de la Claritromicina, un antibiótico macrólido con elevada actividad frente a bacterias grampositivas, buena penetración intraocular y la propiedad de concentrarse en las células fagocíticas, cualidad ésta última ausente en los aminoglucósidos y las cefalosporinas(8, 9).
Actualmente ante la sospecha de una endoftalmitis sacular se propone, tras la toma de muestras de humor acuoso para cultivos y PCR, iniciar el tratamiento con Claritromicina vía oral (500 mg/12h/2semanas)(8, 47). Posteriormente se ha propuesto asociar a la Claritromicina oral el lavado del saco capsular con una solución de Vancomicina, con lo que parece lograrse una mejor respuesta en los casos debidos a Propionibacterium acnes(48).
La aparición de las nuevas quinolonas (gatifloxacino, moxifloxacino) con mayor capacidad de penetración intraocular(49) y un espectro antibacteriano más amplio, hace que pueda estar indicado asociarlas con la Claritromicina para el tratamiento de las endoftalmitis crónicas, pero no hay trabajos que demuestren mejores resultados.
Si el tratamiento conservador fracasa y la inflamación se hace recurrente, estaría indicada una vitrectomía vía parsplana asociada a una capsulectomía parcial amplia sin comprometer la estabilidad de la LIO, intentando eliminar todo el material acantonado posible, inyección de antibióticos intravítreos (Vancomicina 1mg/0,1ml) y corticoides tópicos(50) (fig. 8). Si con ello no se lograse la remisión de la clínica, añadiríamos una capsulectomía total y extracción de la LIO, con posterior implante secundario en sulcus(7, 51), o fijación al iris. Cuanto más agresivo es el tratamiento menores tasas de recurrencia se producen(52, 53, 54).
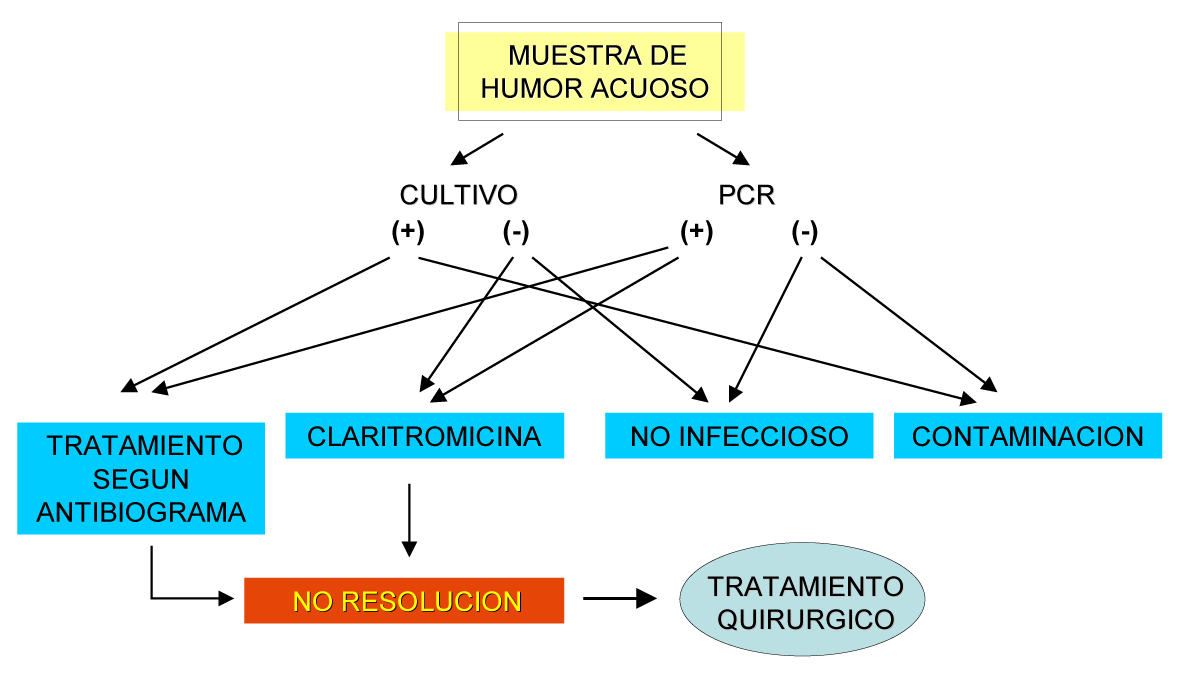
Debido a que no ha sido consensuado un protocolo de actuación a seguir en este tipo de endoftalmitis, hemos propuesto un algoritmo diagnóstico basado en cultivos y PCR de humor acuoso, y terapéutico mediante el uso inicial de Claritromicina, para luego pasar a las opciones quirúrgicas ya descritas si no se controla la clínica o hay una recidiva(38) (fig. 9). Este algoritmo es una aproximación inicial, modificándose según los resultados específicos de cultivo y PCR (por ejemplo, si se detecta una infección fúngica). Recientemente se ha propuesto un algoritmo con toma de muestras de humor acuoso y vítreo, que contempla la etiología fúngica, y sugiere el tratamiento quirúrgico(55).
La inflamación postoperatoria insidiosa requiere un seguimiento meticuloso y considerar cuidadosamente un posible origen infeccioso, pues la evolución recurrente podría ser explicada por la persistencia de gérmenes. Dada la baja frecuencia de las endoftalmitis crónicas consideramos que deben existir centros de referencia para la confirmación diagnóstica y tratamiento de las mismas por oftalmólogos familiarizados con estas situaciones(56).
Bibliografía
- Meisler DM, Palestine AG, Vastine DW, et al. Chronic Propionibacterium endophthalmitis after extracapsular cataract extraction and intraocular lens implantation. Am J Ophthalmol 1986; 102: 733-39.
- Piest KL, Apple DJ, Kincaid MC, Tetz MR, et al. Localized endophthalmitis: a newly described cause of the so-called toxic lens syndrome. J Cataract Refract Surg 1987; 13: 498-510.
- Salvanet-Bouccara A, Cherifi M, Serrhini A, et al. Endophtalmies torpides chez le pseudophake : difficultès diagnostiques et thèrrrrapeutiques. J Fr Ophtalmol 1990 ; 13 : 333-38.
- Fox GM, Jondeph BC, Flynn HW, Pflugfelder SC, Roussel TJ. Delayed-onset pseudophakic endophthalmitis. Am J Ophthalmol 1991; 111: 163-73.
- Busin M, Cusumano A, Spitznas M. Intraocular lens removal from eyes with chronic low-grade endophthalmitis. J Cataract Refract Refract Surg 1995; 21: 679-84.
- Abreu JA, Mesa CG, Santos RJ, y cols. Endoftalmitis sacular. Microcirugía ocular 1992; 2: 10-13.
- Abreu JA, Cordovés L, Mesa CG, Méndez R, et al. Chronic pseudophakic endophthalmitis versus saccular endophthalmitis. J Cataract Refract Surg. 1997; 23: 1122-25.
- Warheker PT, Gupta SR, Mansfield DC, Seal DV. Successful treatment of saccular endophthalmitis with clarithromycin. Eye 1998; 12: 1017-19.
- Warheker PT, Gupta SR, Mansfield DC, Seal DV, Lee WR. Post-operative saccular endophthalmitis caused by macrophage-associated staphylococci. Eye 1998; 12: 1019-21.
- Peyman GA, Lee PJ, Seal DV. Chronic postoperative endophthalmitis. In: Endophthalmitis: Diagnosis and Management. United Kingdom, Taylor and Francis, 2004: 123-135.
- Friberg TR, et al. Propionibacterium acnes endophthalmitis two years after extracapsular cataract extraction. Am J Ophthalmol 1990; 109: 609-10.
- Rogers NK, Fox PD, Noble BA, Kerr K, Inglis T. Aggressive management of an epidemic of chronic pseudophakic endophthalmitis: results and literature survey. Br J Ophthalmol 1994; 78: 115-19.
- Ciulla TA. Update on acute and chronic endophthalmitis. Ophthalmology 1999; 106: 2237-38.
- Fong DS, Pesavento RD. Psudomonas endophthalmitis presenting as subacute inflammation. Arch Ophthalmol 1995; 113: 265.
- Cordovés LM, Abreu JA, Martín F, Méndez R, y cols. Endoftalmitis sacular por enterococcus faecalis. Caso clínico. Arch Soc Canar Oftalmol 1986-1998; 9: 55-57.
- Gokhale VV, Therese KL, Bagyalakshmi R, Biswas J. Detection of Escherichia fergusonii by PCR-based DNA sequencing in a case of delayed-onset chronic endophthalmitis after cataract surgery. J Cataract Refract Surg. 2014 Feb; 40 (2): 327-30.
- Chiquet C, Boisset S, Pechinot A, Creuzot-Garcher C, et al. Massilia timonae as cause of chronic endophthalmitis following cataract surgery. J Cataract Refract Surg. 2015; 41 (8): 1778-80.
- Garg A, Stuart A, Fajgenbaum M, Laidlaw DA, et al. Chronic postoperative fungal endophthalmitis caused by Penicillium citrinum after cataract surgery. J Cataract Refract Surg. 2016 Sep; 42 (9): 1380-1382.
- Ormerod LD, Paton BG, Haaf J, Topping TM, Baker AS. Anaerobic bacterial endophthalmitis. Ophthalmology 1987; 94: 799-807.
- Meisler DM, Mandelbaum S. Propionibacterium associated endophthalmitis after extracapsular cataract extraction. Ophthalmology 1989; 96: 54-61.
- Roussel TJ, Culbertson WW, Jaffé NS. Chronic postoperative endophthalmitis associated with propionibacterium acnes. Arch Ophthalmol 1987; 105: 1199-201.
- Zambrano W, Flynn HW, Pflugfelder SC, et al. Mannagement options for propionibacterium acnes endophthalmitis. Ophthalmology 1989; 96:1100-05.
- Zimmerman PL, Mamalis N, Alder JB, et al. Chronic Nocardia asteroides endophthalmitis after extracapsular cataract extraction. Arch Ophthalmol 1993; 111: 837-840.
- Adán A. Casaroli-Marano RP, Gris O, Navarro R, et al. Pathological findings in the lens capsules and intraocular lens in chronic and intraocular lens in chronic pseudophakic endophthalmitis: an electron microscopy study. Eye. 2008; 22: 113-9
- Lohmann CP, Linde HJ, Reischl U. Rapid diagnosis of infectious endophthalmitis using polymerase chain reaction (PCR): A supplement to conventional microbiological diagnostic methods. Klin Monatsbl Augenheilkd 1997; 211: 22-7.
- Gokhale VV, Therese KL, Bagyalakshmi R, Biswas J. Polymicrobial chronic endophthalmitis diagnosed by culture and molecular technique. Indian J Med Microbiol. 2014 Jul-Sep; 32 (3): 331-2.
- Greisen K, Loeffelholz M, Purohit A, Leong D. PCR Primers and probes for the 16S rRNA gene of most species of pathogenic bacteria, including bacteria found in cerebrospinal fluid. J Clin Microbiol 1994; 32: 335-51.
- Anand A, Madhavan H, Neelam V, Lily T. Use of polymerase chain reaction in the diagnosis of fungal endophthalmitis. Ophthalmology 2001; 108: 326-30.
- Ferrer C, Colom F, Frases S et al. Detection and identification of fungal pathogens by PCR and by ITS2 and 5.8S ribosomal DNA typing in ocular infections. J Clin Microbiol 2001; 39:2873-79.
- Jaeger EE, Carroll NM, Choudhury S et al. Rapid detection and identification of Candida, Aspergillus, and Fusarium species in ocular samples using nested PCR. J Clin Microbiol 2000; 38: 2902-08.
- Okhravi N, Adamson P, Mant R et al. Polymerase chain reaction and restriction fragment length polymorphism mediated detection and speciation of Candida spp. Causing intraocular infection. Invest Ophthalmol Vis Sci 1998; 39: 859-66.
- Okhravi N, Adamson P, Carroll N et al. PCR-based evidence of bacterial involvement in eyes with suspected intraocular infection. Invest Ophthalmol Vis Sci 2000; 41: 3474-79.
- Anand AR, Madhavan HN, Therese KL. Use of polymerase chain reaction (PCR) and DNA probe hybridization to determine the Gram reaction of the infecting bacterium in the intraocular fluids of patients with endophthalmitis. J Infect 2000; 41: 221-6.
- Knox CM, Cevallos V, Margolis TP, Dean D. Identification of bacterial pathogens in patients with endophthalmitis by 16S ribosomal DNA typing. Am J Ophthalmol 1999;128: 511-12.
- Sharma S, Das D, Anand R et al. Reliability of nested polymerase chain reaction in the diagnosis of bacterial endophthalmitis. Am J Ophthalmol 2002; 133: 142-44.
- Hykin PG, Tobal K, McIntyre et al. The diagnosis of delayed post-operative endophthalmitis by polymerase chain reaction of bacterial DNA in vitreous samples. J Med Microbiol 1994; 40: 408-15.
- Lohmann CP, Linde HJ, Reischl U. Improved detection of microorganisms by polymerase chain reaction in delayed endophthalmitis after cataract surgery. Ophthalmology 2000; 107: 1047-51.
- Abreu JA, Cordoves L. Chronic or saccular endophthalmitis: diagnosis and management. J Cataract Refract Surg 2001; 27: 650-1.
- Barry P, Behrens-Baumann W, Pleyer U, Seal D. ESCRS guidelines on prevention, investigation and management of postoperative endophthalmitis. Dublin, ESCRS, July 2005: 13.
- Flemming HC, Wingender J. In: Pellegrino F. Endoftalmitis. En busca del eslabón perdido. Arch Soc Canar Oftal. 2019.
- Casaroli-Marano RP, Adán A. Infecciones oculares asociadas a los implantes oculares. Enferm Infecc Microbiol clin. 2008; 26 (9): 581-8.
- Carter G, Young LS, Bermudez LE. A Subinhibitory Concentration of Clarithromycin Inhibits Mycobacterium avium Biofilm Formation. Antimicrob Agents Chemother. 2004 Dec; 48(12): 4907–4910.
- Rosetti SB, D´Alessandro L, Pellegrino F, Carrasco MA. The effect of ketorolac on biofilm of Staphylococcus epidermidis isolated from post-cataract endophthalmitis. J Ophthalmic Inflamm Infect. 2012 Jun; 2 (2): 89-93.
- Pellegrino F. Endoftalmitis. En busca del eslabón perdido. Arch Soc Canar Oftal. 2019; 30: 1-5.
- Owens SL, Lam S, Tessler HH, Deutsch TA. Preliminary study of a new intraocular method in the diagnosis and treatment of propionibacterium acnes endophthalmitis following cataract extraction. Ophthalmic Surg 1993 Apr;24(4):268-72.
- Pichi F, Nucci P, Baynes K, Carrai P, et al. Acute and chronic Staphylococcus epidermidis post-operative endophthalmitis: The importance of biofilm production. Int Ophthalmol. 2014 Dec; 34(6): 1267-70.
- Abreu JA, Cordovés LM. Endoftalmitis sacular. Arch Soc Esp Oftalmol. 2001; 76: 5-6.
- Pellegrino FA, Wainberg P, Schlaen A, Ortega C, et al. Oral clarithromycin as a treatment option in chronic post-operative endophthalmitis. Arch Soc Esp Oftalmol 2005 Jun; 80(6); 339-44.
- García-Saenz MC, Arias-Puente A, Fresnadillo-Martinez MJ, Carrasco-Font C. Human aqueous humor levels of oral ciprofloxacin, levofloxacin, and moxifloxacin. J Cataract Refract Surg 2001; 27(12): 1969-74.
- Abreu JA, Cordovés L, García-Sáenz MC, Amigó A, y cols. Actualización en la prevención y tratamiento de la endoftalmitis postquirúrgica. Arch Soc Canar Oftal. 2019; 30: 57-64.
- Pérez A, González J, Gimeno A, Clement F, Carrasco C. Tratamiento de las endoftalmitis crónicas tras la cirugía de las cataratas. Arch Soc Esp Oftalmol 2000; 75:339-46.
- Daramo VA, Ting TD. Treatment of Propionibacterium acnes endophthalmitis. Curr Opin Ophthalmol 2001; 12:225-29.
- Clark WL, Kaiser PK, Flynn HW et al. Treatment strategies and visual acuity outcomes in chronic postoperative propionibacterium acnes endophthalmitis. Ophthalmology 1999; 106: 1665-70.
- Aldave AJ, Stein JD, Deramo VA et al. Treatment strategies for postoperative Propionibacterium acnes endophthalmitis. Ophthalmology 1999; 106: 2395-401.
- Basauri E, Aragón JA, Catalá J, Cordovés L, y cols. Endoftalmitis postoperatoria crónica. En: Guías de Práctica Clínica de la SERV-Segunda revisión. Endoftalmitis Infecciosa. Madrid, SERV, Diciembre 2017: 46-49.
- Abreu R. Endoftalmitis sacular tras cirugía de la catarata. Estudio retrospectivo. An Inst Barraquer (Barc) 2006; 35 (1-2): 13-20.
Autores

José Augusto Abreu Reyes
– Oftalmólogo
– Centro Hospitalario Universitario de Canarias – La Laguna – Tenerife – Islas Canarias – España

Luis Cordovés Dorta
– Oftalmólogo
– Centro Hospitalario Universitario de Canarias – La Laguna – Tenerife – Islas Canarias – España

Iván Rodríguez Talavera
– MIR cuarto año
– Centro Hospitalario Universitario de Canarias – La Laguna – Tenerife – Islas Canarias – España