Desprendimiento de membrana de Descemet postquirúrgico, una complicación inusual, pero importante
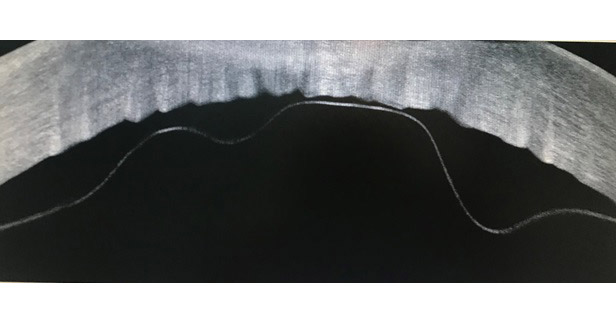
El Dr. Perrone nos relata la historia de una paciente femenina, de edad no especificada, con el único antecedente de una facoemulsificación con implante de lente intraocular en el ojo derecho, con una buena evolución posquirúrgica. Posteriormente, la paciente inicia su padecimiento actual tras una cirugía de facoemulsificación con implante de lente intraocular en su ojo izquierdo (OS), cirugía que tuvo una duración aproximada de 6 minutos y se desarrolló sin ninguna eventualidad. En el posquirúrgico mediato se identifica un edema corneal importante en dicho OS y que se maneja inicialmente de manera conservadora, solo con vigilancia. En la siguiente consulta el paciente es revalorado, encontrándose los siguientes datos a la exploración con lampara de hendidura: persistencia del edema corneal, desprendimiento extenso de la membrana de Descemet (MD) y formación de una pseudocámara por la misma membrana. Se realiza un OCT de segmento anterior, que confirma el diagnóstico (Figura 1).
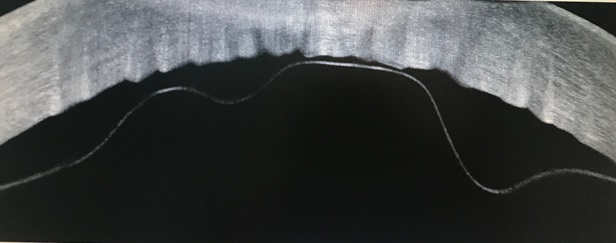
El Dr. Perrone posteriormente reviso el vídeo de la cirugía, con el cual logró determinar que el DPD se produjo al momento de cerrar la incisión corneal principal por hidratación, en los pasos finales de la cirugía. Con esta información, el Dr. Perrone realiza un abordaje quirúrgico inicial colocando una burbuja de aire al 100% en quirófano con realización de iridotomía inferior, debido a que a las 24 horas se mantiene desprendida la membrana de Descemet de limbo a limbo decide volver al quirófano para colocar una burbuja de Hexafluoruro de Azufre (SF6) al 20% y una incisión para drenar parcialmente el líquido atrapado en la pseudocamara. A las 24 horas se corrobora que continúa el DPD por lo que tras estos acontecimientos el Dr. acude a los expertos del foro por lo que se crea un hilo en el Foro FacoElche para compartir opiniones y experiencia sobre esta patología.
Con fines académicos dividiremos las opiniones de los miembros del foro en:
Manejo preventivo
- El Dr. Patricio Navarro sugiere algunas medidas para prevenir el DPD al infiltrar la herida quirúrgica
- a) Si la cirugía es rápida practicamente no hace falta edematizar,
- b) Cambiar a incisiones más grandes de 2.2 a 2 .4 mm
- c) Usar solo bisturíes bien afilados – diamante , o acero con pocos ciclos de Statim
- d) Edematizar sólo las comisuras laterales evitando el techo de la incisión ( dejarlo para casos de cirugias mas peleadas )
- El Dr. Eduardo Viteri modifica el tamaño de su herida a 2.4 cuando la potencia del lentes es mayor de 22 D.
Manejo médico
- El Dr. Javier Maldacena nos comenta que uno de sus casos mejoró espontáneamente a los 35 días del postoperatorio, y resalta que la vigilancia única también es una opción de manejo.
Manejo quirúrgico
- el Dr. Jorge Luis Buonsanti inquiere si las burbujas de aire fueron instiladas cubriendo completamente la cámara anterior, para asegurarse de tener el máximo efecto posible.
- El Dr. Reinaldo Echavarria nos comparte la experiencia de un colega que en una complicación similar por inyección inadvertida de viscoelástico por debajo de la MD, usó una aplicación de YAG láser en la MD para solucionarlo.
- El Dr. Julian Venero sugiera la instilación de una burbuja de aire en la cámara anterior, pero manteniéndola a presión una hora, para después reducirla a ¾ del espacio cameral. Asimismo, inquiere si puede ser viscoelástico el material en la pseudocamara (siendo esto descartado por el Dr. L. Perrone).
- El Dr. Randall Ulate nos comenta que el ha tenido buenos resultados con Perfluoropropano (C3F8) al 14% (concentración no expandible), ingresando por el meridiano donde esta aplicada la MD y aplicándolo lentamente, visualizando la reaplicación de la MD y manteniendo una posición de decúbito supino las 2 horas posteriores y control para confirmar la reaplicación. Con respecto a la técnica del Dr. Randall, el Dr. Reinaldo Echavarria opina que la aplicación de gas y apertura de orificios en Descemet (12, 3, 6, 9) con láser YAG y mantenimiento en posición supina también serían una opción adecuada.
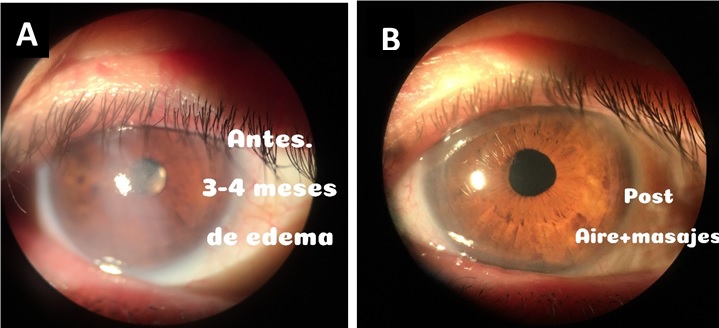
- El Dr. Andres Suarez nos comenta su experiencia con un caso de DPD, consistiendo su abordaje en inyección de gas en la cámara anterior, realizar una incisión corneal que llegue hasta la pseudocamara y masajear la córnea con una cánula para drenar el líquido con presión desde ambos frentes. El resultado pre y postoperatorio de su paciente se presenta en la Figura 2.
- El Dr. Randall Ulate, opina que la realización de un agujero en la MD por YAG podría tener riesgo de crear una pseudocamara persistente, recomendando mejor usar gas intracameral, instilándolo primero en el área donde esta aplicada la MD, para que “planche” el resto del DPD, y en caso de hipertensión ocular, drenar humor acuoso por otra incisión corneal. Comparte el siguiente vídeo para ejemplificar su técnica
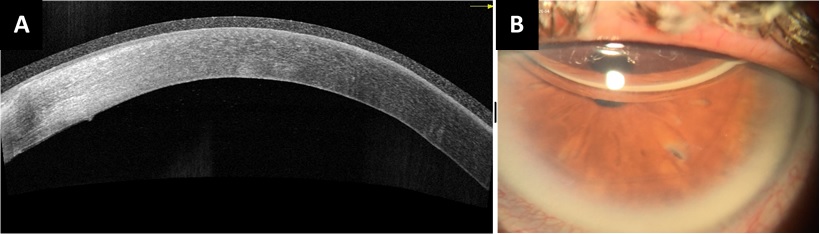
Finalmente, el Dr. Perrone nos comenta el que la paciente fue reintervenida. Se realizó una inyección intracameral de aire con un abordaje superior muy cercano al limbo para asegurar que la cánula se encuentra por debajo de la membrana de Descemet y llenando ¾ de la cámara anterior con aire el cual desplazó el líquido al sector inferior, a continuación, se localizó la zona de mayor concentración líquida en la pseudocamara mediante un dispositivo desarrollado por el Dr. Szuster y se evacuó a través de 2 incisiones de drenaje con una aguja 30G una buena cantidad de líquido. Para concluir se llenó el ¼ restante de la cámara anterior con gas, se masajeó la córnea con el objetivo de eliminar el líquido que se mantuviera en la interfase y se dejó a la paciente con medidas de posición el fin de semana.Por último, el Dr. Perrone expresa un agradecimiento personal al Dr. Nestor Szuster, por su valiosa ayuda y el desarrollo de un dispositivo para evaluar de forma intraoperatoria la Membrana de Descemet de una forma sencilla y poco costosa. En el control posquirúrgico se comprueba que la MD esta reaplicada al 100%. El resultado final se aprecia en la Figura 3.
De otro hilo iniciado por el Dr. Luis J Escaf sobre un DPD diagnosticado a los 4 meses postoperatorios se realizaron las siguientes recomendaciones (solo se mencionan las que no se han discutido previamente)
- Manejo médico
- El Dr. Juan G Ortega nos comenta que uno de sus casos mejoró espontáneamente.
- Manejo quirúrgico
- José Antonio Gegúndez agregar al uso de SF6 y posición, gotas anti edema cada 4 horas.
- Randall Ulate Piedra, considerar DMEK en caso de que no resuelva con la técnica previamente descrita
- Noé Rivero, confirmar la concentración adecuada de los gases para evitar que se expandan (SF6 al 20% y C3F8 al 14%), recordadando que el C3F8 se mantiene por más tiempo por lo que es el de elección.
Revisión de la literatura
Definición y epidemiología del desprendimiento posquirúrgico de Descemet
La MD es, de exterior a interior, la cuarta capa de la córnea y corresponde a la membrana basal del endotelio corneal(1). Mide al nacimiento alrededor de 3 micras y aumenta hasta la edad adulta, cuando alcanza un grosor de 8-10 micras(1). El análisis de su histología y ultraestructura revela una subdivisión en 3 capas: una anterior sin bandas visibles (0.3 micras), una media con bandas (2-4 micras) y una posterior sin bandas (mayor o igual a 4 micras)(1). Entre sus constituyentes más importantes se encuentran la colágena tipo IV, el tipo VIII, laminina y fibronectina(1). La MD y el endotelio corneal poseen un rol fundamental en el mantenimiento de la integridad y transparencia corneal(1, 2). El DPD se define como la separación tras un procedimiento quirúrgico de la MD del estroma posterior, permitiendo la acumulación de líquido en una pseudocamara(3). Fue reportado por primera vez en la literatura médica a principios del siglo XX, en 1927 por Weve(4) y en 1928 por Samuels(5). El DPD puede ocurrir como una complicación de diversas cirugías intraoculares, como iridectomía, trabeculectomía, esclerotomia, vitrectomía por pars plana, viscocanalostomía y facoemulsificación(6). Debido a la alta frecuencia con que se realiza la cirugía de facoemulsificación, es ésta una de las intervenciones quirúrgicas donde más se ha descrito y estudiado esta complicación(2, 3, 6, 7).
Diversos estudios han reportado la incidencia del DPD tras la cirugía de catarata. Desprendimientos pequeños o focales y alteraciones anatómicas de la MD han sido descritas desde en 5 hasta 43 % de pacientes tras haberse sometido a una extracción extracapsular de catarata (EECC)(8, 9). Un DPD que conlleve una disminución significativa de la agudeza visual ha sido descrito con una incidencia de 2.6 y 0.5% tras EECC y facoemulsificación, respectivamente(6). Recientemente Ti et al(10) y Kumar et al(2) reportan una incidencia tras facoemulsificación de DPD de 0.044 y 0.52 %, tras haber estudiado 36238 y 44281 procedimientos, respectivamente.
Causas y factores de riesgo
El DPD usualmente aparece tras la formación incidental de rupturas traumáticas en sitios de incisión, que permiten el acumulo de líquido entre la MD y el estroma posterior(6). Predisposiciones personales, en base a alteraciones de la adhesión entre el estroma posterior y la MD han sido propuestos por algunos autores(11, 12). Asimismo, casos de aparición de DPD en hermanos han sido reportados en la literatura, existiendo la posibilidad de una susceptibilidad genética(13). Diversos factores de riesgo han sido reportados para la aparición de DPD (Tabla 1).
| Quirúrgico | Anatómico | Paciente |
|
Cámara anterior estrecha |
|
Manifestaciones clínicas, diagnóstico y estudios ancilares
El DPD puede comúnmente observarse por biomicroscopia, ya sea intraoperatoriamente o en la lámpara de hendidura en los días después del procedimiento quirúrgico(6). Como en el caso reportado en nuestro foro (Perrone, Luciano; comunicación personal) la grabación del procedimiento quirúrgico puede permitir al cirujano revisarlo y detectar la formación y características del DPD. Signos y síntomas comunes del DPD son edema corneal difuso o localizado, usualmente correspondiente con el área del desprendimiento y que persiste más de 2 semanas, haze corneal, pliegues en la MD, vesículas epiteliales y agudeza visual disminuida en el ojo afectado(6, 7). Es necesario recordar que el edema corneal severo tras facoemulsificación se presenta en la evaluación posquirúrgica de un número considerable de pacientes, no todos teniendo un DPD. En un estudio por Tsauousis et al(14), el % de pacientes sanos que presentaron edema corneal severo tras facoemulsificación fue 32.5, 7.5 y 4.5 en el día 1, 7 y 14 posquirúrgico respectivamente. La continua mejoría y duración menor de 2 semanas son datos que sugieren un edema corneal no asociado a DPD(6). Para la visualización de DPD pequeños o escondidos detrás de corneas con un edema muy severo, puede ser de ayuda la gonioscopia y la deshidratación corneal con glicerina tópica(6). Entre los estudios auxiliares para el DPD se encuentran la ultrabiomicroscopia (UBM) y el OCT de segmento anterior (OCTSA)(6). Morinelli y colaboradores, reportan una adecuada visualización y localización del DPD en la reparación quirúrgica guiada por UBM en pacientes con intentos fallidos previos de resolución quirúrgica(15). De forma similar, Sharma y col(16) reportan una alta tasa de reconocimiento y adecuada caracterización del DPD mediante OCTSA. Diversos autores han tratado de clasificar los DPD en base a diversas características(2, 6). Recientemente, Kumar y colaboradores(2), desarrollaron un algoritmo de clasificación y asignación de tratamiento de los DPD llamado HELP (Height, extent, lenght and pupil-based) basado en las dimensiones del DPD medido por OCTSA y su extensión en base a 3 zonas corneales que los autores delimitaron. Los pacientes fueron incluidos en grupos de tratamiento médico o quirúrgico, en base a los resultados del algoritmo, y tuvieron reaplicaciones de la MD en más del 95% de ambos grupos(2).
Tratamiento y prognosis
Debido a su baja incidencia, no existen estudios clínicos aleatorizados que hayan evidenciado el mejor tratamiento del DPD. Entre las medidas posibles de tratamiento existes aquellas con manejo conservador, médico o quirúrgico(6). El manejo conservador, consistente en vigilancia y seguimiento periódico puede estar indicado en algunos casos, pues la resolución espontánea de algunos DPD está bien documentada en la literatura(17, 18). Aun así, una vigilancia estrecha es necesaria para detectar a tiempo la formación de fibrosis o cicatrices corneales que puedan afectar la capacidad visual(6). El manejo médico consiste en el uso de esteroides tópicos y agentes hiperosmóticos(6). Los regímenes e indicaciones varían entre los diferentes grupos de investigación(2, 6, 19). El tratamiento quirúrgico del DPD puede realizarse mediante varios procedimientos: La reaplicación con aire o gas (Descemetopexia), reaplicación con líquidos como hialuronato de sodio, fijación con suturas, queratoplastia penetrante y la queratoplastia endotelial de membrana de Descemet han sido descritos en la literatura médica(6). Diversos estudios de análisis retrospectivo han encontrado que la Descemetopexia representa una opción segura y eficaz (reaplicación en 71-87.5% de los casos)(3, 10). Sin embargo, no hay una evidencia sólida acerca de con que gas debe realizarse la Descematopexia(6). La reaplicación de la MD con hialuronato de sodio también ha sido reportada como eficaz(20), así como la fijación con suturas(6). La queratoplastia penetrante y la queratoplastia endotelial de membrana de Descemet suelen considerarse procedimientos de última línea(6). La identificación de los criterios más importantes para decidir entre un tratamiento médico o quirúrgico ha sido abordada por múltiples estudios(2, 6). El algoritmo de Kumar y colaboradores(2), es una escala basada en parámetros anatómicos que pueden fácilmente obtenerse por OCTSA y exploración clínica (2).
![Figura 4. Algoritmo HELP de Kumar et al [2] adaptado al español.](https://www.facoelche.com/wp-content/uploads/2019/08/desprendimiento-descemet-4.jpg)
Agradecimientos
Los autores agradecen la oportunidad de redactar este artículo para el FACOBLOG, así como la excelente disposición de los miembros del foro para el dialogo y discusión.
Bibliografía
- T. Nishida, S. Saika and N. Morishige, «Cornea and Sclera: Anatomy and Physiology,» in Cornea, Elsevier, Inc., 2017, pp. 14-15.
- «Kumar DA, Agarwal A, Sivanganam S, Chandrasekar R. Height-, extent-, length-, and pupil-based (HELP) algorithm to manage post-phacoemulsification Descemet membrane detachment. Journal of Cataract & Refractive Surgery. 2015 Sep 1;41(9):1945-53».
- «Odayappan A, Shivananda N, Ramakrishnan S, Krishnan T, Nachiappan S, Krishnamurthy S. A retrospective study on the incidence of post-cataract surgery Descemet’s membrane detachment and outcome of air descemetopexy. British Journal of Ophthalmology. 2018 F».
- «Weve H. Separation of the membrane of Descemet after extraction of the lens. Nederl Tijdschr Geneesk. 1927;71(4 pt 2):398-400».
- «Samuels B. Detachment of Descemet’s membrane. Transactions of the American Ophthalmological Society. 1928;26:427».
- «Benatti CA, Tsao JZ, Afshari NA. Descemet membrane detachment during cataract surgery: etiology and management. Current opinion in ophthalmology. 2017 Jan 1;28(1):35-41.».
- «Guo P, Pan Y, Zhang Y, Tighe S, Zhu Y, Li M, Shen X, Lin B, Pan B, Liu X, Cheng H. Study on the classification of Descemet membrane detachment after cataract surgery with AS-OCT. International journal of medical sciences. 2018;15(11):1092».
- «Monroe WM. Gonioscopy after cataract extraction. South Med J. 1971;64:1122-4».
- «Anderson CJ. Gonioscopy in no-stitch cataract incisions. Journal of cataract and refractive surgery. 1993 Sep;19(5):620-1.».
- «Ti SE, Chee SP, Tan DT, Yang YN, Shuang SL. Descemet membrane detachment after phacoemulsification surgery: risk factors and success of air bubble tamponade. Cornea. 2013 Apr 1;32(4):454-9.».
- «Kansal S, Sugar J. Consecutive Descemet membrane detachment after successive phacoemulsification. Cornea. 2001 Aug 1;20(6):670-1.».
- «Hirano K, Kojima T, Nakamura M, Hotta Y. Triple anterior chamber after full-thickness lamellar keratoplasty for lattice corneal dystrophy. Cornea. 2001 Jul 1;20(5):530-3.».
- «Felipe AF, Rapuano CJ, Nottage JM, Abazari A. Descemet membrane detachment among siblings: role of anatomic and familial predisposition. Cornea. 2012 Jul 1;31(7):836-40.».
- «Tsaousis KT, Panagiotou DZ, Kostopoulou E, Vlatsios V, Stampouli D. Corneal oedema after phacoemulsification in the early postoperative period: A qualitative comparative case-control study between diabetics and non-diabetics. Annals of Medicine and Surger».
- «Morinelli EN, Najac RD, Speaker MG, Tello C, Liebmann JM, Ritch R. Repair of Descemet’s membrane detachment with the assistance of intraoperative ultrasound biomicroscopy. American journal of ophthalmology. 1996 Jun;121(6):718-20».
- «Sharma N, Gupta S, Maharana P, Shanmugam P, Nagpal R, Vajpayee RB. Anterior Segment Optical Coherence Tomography–Guided Management Algorithm for Descemet Membrane Detachment After Intraocular Surgery. Cornea. 2015 Sep 1;34(9):1170-4».
- «Minkovitz JB, Schrenk LC, Pepose JS. Spontaneous resolution of an extensive detachment of Descemet’s membrane following phacoemulsification. Archives of Ophthalmology. 1994 Apr 1;112(4):551-2».
- «Iradier MT, Moreno E, Aranguez C, Cuevas J, Feijoo JG, Sanchez JG. Late spontaneous resolution of a massive detachment of Descemet’s membrane after phacoemulsification. Journal of Cataract & Refractive Surgery. 2002 Jun 1;28(6):1071-3.».
- «Chiu LY, Tseng HY. Descemet’s membrane detachment following uneventful phacoemulsification surgeries: A case report. Medicine. 2018 Apr;97(15).».
- «Sonmez K, Ozcan PY, Altintas AG. Surgical repair of scrolled descemet’s membrane detachment with intracameral injection of 1.8% sodium hyaluronate. International ophthalmology. 2011 Oct 1;31(5):421-3.».
- «Polat N, Ulucan PB. Nontraumatic Descemet Membrane Detachment with Tear in Osteogenesis Imperfecta. Ophthalmology and therapy. 2015 Jun 1;4(1):59-63.».
- «Maharana PK, Sharma N, Vajpayee RB. Acute corneal hydrops in keratoconus. Indian journal of ophthalmology. 2013 Aug;61(8):461.».
Autores

Lucas Antonio Garza
– Residente de Oftalmología-Instituto Tecnológico y de Estudios Superiores de Monterrey, Instituto de Oftalmología y Ciencias Visuales. Monterrey, México.

Manuel Alejandro Garza León
-Cirujano Oftalmólogo, subespecialista en enfermedades inflamatorias y cornea y cirugía refractiva.
-Universidad de Monterrey. Monterrey, México.