

Además, el Dr. Mansur destacó la evidencia clínica del uso de una gota de atropina al 0.01% una vez al día y la importancia que tiene que los niños sigan una buena higiene visual (regla 20-20-2: descanso de 20 segundos mirando de lejos por cada 20 minutos de trabajo de cerca y pasar al menos 2 horas diarias realizando actividades al aire libre).
El Dr. G. Arce recordó la evidencia de la ortoqueratología en la disminución de la progresión de la miopía. El Dr. Burga Kuroda, Dr.Urbe, Dr. Quezada, Dr. G. Arce, Dr. Iribarren y Dr. Tello compartieron su experiencia empleando atropina al 0.01 % en niños miopes. El Dr. Fau aportó un interesante metaanálisis sobre el tema.
Como vemos las propuestas fueron variadas lo que nos da pié a hacer una revisión del tema en el FacoBlog.
1. Introducción
La miopía supone en la actualidad un importante problema de salud pública, especialmente en Asia oriental, donde ya ha alcanzado nivel de pandemia con una prevalencia del 80-90% en niños entre los 17-18 años(1). Diferentes metaanálisis han demostrado un crecimiento dramático de la prevalencia de la miopía también en Europa (alcanzando un 46% en la población de 25 años)(2) y en los Estados Unidos (prevalencia entre el 20% y el 50% en la población mayor de 12 años)(3). Se ha estimado que la prevalencia mundial de miopía y miopía alta (definida como un defecto refractivo de ≥ 6.00 dioptrías) aumentará sustancialmente, afectando a casi 5 mil millones y mil millones de personas, respectivamente en 2050(4).
Esto implica que, si no conseguimos frenar esta epidemia silenciosa, en 2050 la mitad de la población mundial puede verse afectada por la miopía.

2. Complicaciones
Aparte del importante coste socioeconómico que esta patología supone, la miopía es también un factor de riesgo para desarrollar múltiples enfermedades oculares como maculopatía miópica, glaucoma de ángulo abierto, cataratas, membranas neovasculares, desprendimiento de retina y desgarros retinianos. Estas complicaciones típicamente afectan a personas de edad avanzada y suponen una importante causa de discapacidad visual.
Aunque cualquier grado de miopía supone un riesgo para desarrollar estas complicaciones, las longitudes axiales de 26 mm o más y los errores refractivos de −6 dioptrías (D) o superiores se asocian significativamente con un mayor riesgo de discapacidad visual durante toda la vida(5). Además, se ha demostrado que un inicio temprano de la miopía está relacionado con un grado más grave de la enfermedad durante la edad adulta(6). Dada la combinación del aumento de la prevalencia de la miopía y el envejecimiento de la población(7), se espera que la frecuencia de estas complicaciones aumente en un futuro.
Por lo tanto, se necesita con urgencia un tratamiento eficaz para retardar o incluso detener la progresión de la miopía en niños pequeños.
3. Etiología
La miopía es una enfermedad multifactorial resultado de la interacción entre los factores genéticos y los factores ambientales.
3.1 Factores genéticos
Está bien documentada la herencia familiar de la miopía, existiendo una asociación positiva entre la miopía de los padres y el riesgo del niño de desarrollar la enfermedad(8). La miopía común habitualmente se transmite como un rasgo complejo. Sin embargo, aunque la alta miopía puede transmitirse como un rasgo complejo, también puede hacerlo como un rasgo mendeliano, incluida la herencia autosómica dominante, autosómica recesiva y la recesiva ligada al X.
Sin embargo, los estudios de asociación de genoma han determinado que los loci susceptibles de causar un error refractivo tienen un papel marginal en el riesgo de desarrollar miopía(9). Esto sugiere que tiene mayor relevancia los factores no genómicos en el desarrollo y progresión de la miopía, como los cambios epigenéticos y el medio ambiente.
3.2 Factores ambientales
Se considera que los factores ambientales juegan un papel fundamental en el desarrollo y progresión de la miopía. Así se ha evidenciado en estudios en modelos animales en donde se ha modulado el crecimiento de los ojos mediante retroalimentación visual(10). Además, el cambio genético es lento y no puede explicar el aumento de la prevalencia de la miopía observada en muchos países de Asia oriental y sudeste asiático(11).
Múltiples estudios observacionales en humanos muestran una asociación de la miopía y diferentes factores ambientales(12).
- Falta de tiempo al aire libre: Un reciente metaanálisis establece que las actividades prolongadas al aire libre tienen un impacto más importante en la reducción de la aparición de la miopía que en ralentizar la progresión de la enfermedad(13). Se desconoce el mecanismo que explique cómo el tiempo que se pasa al aire libre reduce la aparición de la miopía. Algunos estudios con modelos animales apoyan la hipótesis del papel de la dopamina en asociación con la exposición de luz(14).

Imagen 3. La falta de actividades al aire libre se ha asociado al aumento de la prevalencia de la miopía en la población joven(14). - Alto nivel educativo: Se ha observado que, entre sujetos con el mismo riesgo genético, en aquellos con nivel educativo más alto existe mayor riesgo de inicio de la miopía frente a aquellos con niveles educativos inferiores(15). Esto podría deberse a que los sujetos con alto nivel educativo desarrollan más trabajo cercano a la vez que reducen las actividades que desarrollan al aire libre(16,17).
- Actividad de trabajo cercana: No existe todavía evidencia que demuestre que se trate de un factor de riesgo independiente para el desarrollo de la miopía.
- Vivir en una sociedad urbana: Existe una mayor prevalencia de miopía en zonas urbanas que en zonas rurales(18) lo que puede explicarse por la falta de actividades al aire libre combinadas con un trabajo cercano más intensivo debido al nivel educativo mayor en áreas urbanas en comparación con zonas rurales.
4. Tratamiento
Se han investigado diferentes intervenciones profilácticas que persiguen frenar la progresión de la enfermedad.
4.1 Tratamiento óptico para el control de la miopía
Se basa en la observación en modelos animales de que el desenfoque hipermetrópico relativo en la retina periférica que se produce en pacientes miopes puede provocar el alargamiento axial del ojo(19). Mediante diferentes enfoques ópticos se ha tratado de conseguir un desenfoque miópico periférico que inhiba el crecimiento del ojo.
- Gafas con lentes progresivas o bifocales: Su uso se basó en la teoría de que la disminución de la acomodación durante el trabajo cercano que se consigue con el uso de este tipo de lentes reduce el desenfoque hipermetrópico en la retina. Actualmente no se considera una opción viable para frenar la progresión de la miopía, ya que no consiguen una reducción clínicamente significativa de la progresión miópica en comparación con placebo.
- Ortoqueratología (Orto-K): Son lentes de contacto permeables al gas de uso nocturno que remodelan temporalmente la superficie corneal, aplanando la córnea central y curvando la zona periférica media. Diferentes estudios han demostrado que las Orto-K retardan la progresión de la miopía a través de una reducción del error refractivo periférico hipermetrópico logrando un enlentecimiento del alargamiento de la longitud axial del ojo(20,21). Sin embargo, no debe despreciarse los problemas de tolerabilidad en niños pequeños que provocan un importante porcentaje de pacientes que abandonan el tratamiento, lo que puede conllevar a una progresión más rápida de la miopía o “efecto rebote”(22). Además, no debemos olvidar el mayor riesgo de queratitis infecciosa en portadores de Orto-K(23), estando implicados de forma más frecuente gérmenes especialmente agresivos como la Pseudomona aeruginosa y Acanthamoeba(24).
- Lente de contacto blandas para el control de la miopía: Son lentes de contacto con un diseño multifocal especialmente diseñadas para el control de la miopía, que tienen una zona óptica central (para corregir el error de refracción a distancia) y una o más partes periféricas de mayor potencia (para reducir el desenfoque periférico hipermetrópico imponiendo un desenfoque miope). Varios estudios mostraron que son eficaces en la reducción de la progresión miópica(25,26,27). Las lentes de contacto diarias tienen varias ventajas en niños: son más seguras (menos riesgo de queratitis infecciosas que las orthoK de uso nocturno)28 y más cómodas (mayor adherencia que el uso de gafas o atropina)(27,29). Sin embargo, actualmente existen pocos estudios que evalúen este tratamiento y algunos de ellos podrían estar influenciados por los intereses comerciales. Por ello son necesarios más estudios que evalúen la eficacia de este tratamiento a largo plazo.
4.2 Tratamiento farmacológico
Diferentes fármacos han sido evaluados en diferentes ensayos con humanos para el control de la miopía: atropina, pirenzepina, tropicamida, 7-metilxantina y algunos agentes hipotensores como el timolol. La revisión de datos de la Cochrane en 2011 evaluó todos ellos, concluyendo que el tratamiento más eficaz para retrasar la progresión de la miopía son los agentes antimuscarínicos, y en particular la atropina(30).
ATROPINA
Actualmente es considerado el tratamiento más eficaz para retrasar la progresión de la miopía(30). Se trata de un antagonista muscarínico no selectivo, cuyo mecanismo exacto de acción todavía no se conoce con exactitud. Parece que su eficacia es debida a la modulación neuroquímica que ejerce sobre los neurotransmisores que actúan a nivel de la retina, coroides, epitelio pigmentario de la retina y en la esclerótica(31). Algunos estudios descartan que su mecanismo de acción sea debido al efecto que ejerce la atropina sobre la acomodación(32,33), tal y como se consideró inicialmente, ya que estudios en pollos mostraron que la atropina actuaba a través de los receptores nicotínicos en lugar de los muscarínicos en el músculo ciliar. Además, en modelos animales la atropina es efectiva en prevenir el crecimiento ocular miópico incluso después de abolir la acomodación destruyendo el núcleo de Edinger-Westphal o de seccionar el nervio óptico(34).

La eficacia de la atropina ha sido evaluada a diferentes concentraciones:
- El estudio de tratamiento de la miopía infantil ATOM 1 se evaluó la eficacia de la atropina al 1% frente a placebo en 400 niños asiáticos de 6 a 12 años con error refractivo de equivalente esférico entre -1.00 y -6.00 dioptrías (D) y astigmatismo ≤ -1.50D. Después de un periodo de tratamiento de 2 años, el grupo tratado con atropina al 1% mostró una progresión de la miopía significativamente más lenta con una diferencia de 0.92 D de equivalente esférico y 0.40 mm de longitud anual en comparación con el grupo que recibió placebo. Además, no produjo efectos adversos graves a excepción de las reacciones alérgicas (4,5%), el deslumbramiento (1,5%) y la visión de cerca borrosa (1%). Se concluyó que la atropina al 1% era un tratamiento bien tolerado y efectivo en la reducción de la progresión de miopía moderada y en la elongación axial ocular de los niños asiáticos(35).
- Sin embargo, aunque la atropina al 1% era efectiva en la reducción de la progresión de la miopía, producía efectos adversos visuales (deslumbramiento, fotofobia, visión cercana borrosa) consecuencia de la cicloplejia y la midriasis provocada por la atropina a altas concentraciones. Por ello posteriormente se llevó a cabo el estudio de tratamiento de la miopía infantil ATOM 2, que trataba de comparar la eficacia clínica y la seguridad de dosis más bajas de atropina (0.5%, 0.1% y 0.01%) con los controles históricos del estudio ATOM1. 400 niños asiáticos de 6 a 12 años con miopía de al menos 2.0 D fueron asignados de forma aleatoria a cada uno de los grupos. Tras 2 años de tratamiento, no hubo diferencias clínicamente significativas entre los tres grupos en cuanto a la progresión de la miopía (0.19D) y el cambio de la longitud axial (0.14mm). Sin embargo, la atropina al 0.01% no produjo cambios significativos en la acomodación, tamaño pupilar ni efectos en la visión cercana. Tampoco hubo efectos adversos en el grupo de atropina al 0.01%(36).
Posteriormente se realizaron investigaciones similares en niños de diferentes etnias, donde se constataron una eficacia y un perfil de efectos adversos similares(37). Además, en estudios con un mayor tiempo de seguimiento y tratamiento, la atropina al 0.01% ha mostrado mayor eficacia clínica a largo plazo con menos efectos secundarios visuales en comparación con las dosis más altas(38) (Figura 1).
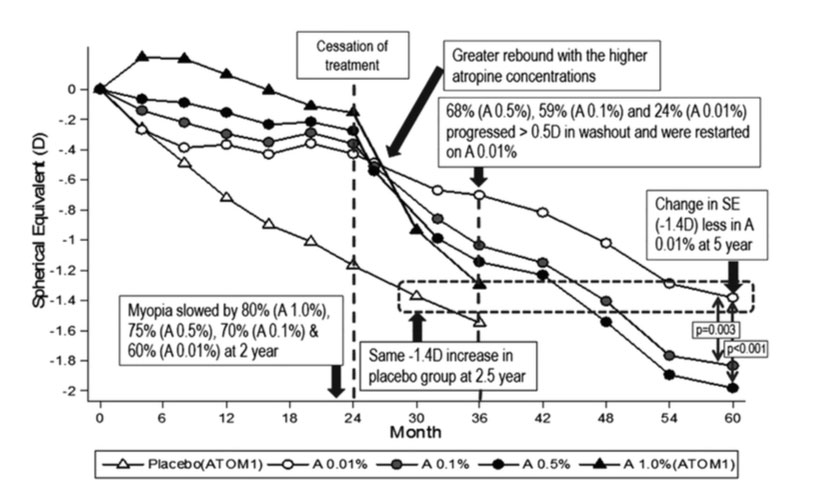
Se ha observado un “efecto rebote”, es decir, una tasa de progresión más rápida de la miopía al interrumpir el tratamiento con atropina en comparación con la progresión durante el tratamiento con respecto a controles(39,40). Este rebote ocurre sobre todo en los primeros 6 meses tras suspender el tratamiento(39). Se ha evaluado que la miopía neta es menor al final del año sin tratamiento en el grupo tratado con atropina al 1%, aunque se desconoce si la miopía llega a ser similar al grupo control a largo plazo. El fenómeno rebote se relaciona con la dosis de atropina, siendo menor con dosis bajas de atropina (0.01%)(40).
En conclusión, actualmente la atropina al 0.01% es considerada de elección, ya que garantiza la mejor eficacia clínica a largo plazo con menor efecto rebote y con efectos secundarios más tolerables en comparación con las dosis más altas.
NUEVOS HORIZONTES
- Estudio LAMP: Un reciente estudio publicado en 2019 46 compara es uso de atropina al 0,05%, 0,025% y 0,01%. La concentración más efectiva fue la de 0,05%, en cambio, la concentración a 0,01% produjo un cambio esférico pero no en la longitud axial.
- Atropina al 1% diaria en niños altos miopes: Un reciente estudio prospectivo de la India evaluó la eficacia clínica de la atropina al 1% en niños con miopía progresiva (definida como 0.5 D / año) y alta miopía al inicio del estudio (miopía media 5.2 D). Después de un año de seguimiento, se observó una disminución de la tasa de progresión de la enfermedad. Los autores sugieren que la atropina al 1% pueda ser un tratamiento de segunda línea para las progresiones rápidas y en pacientes no respondedores a dosis más bajas de atropina. Sin embargo, este estudio tiene varias limitaciones: no se evaluaron el periodo de lavado ni el efecto rebote y la mayor parte de la población era de etnia china. Por ello son necesarios ensayos clínicos en otras poblaciones étnicas que evalúen la eficacia y seguridad a largo plazo de la atropina al 1%(41).
- Difrarel oral: Se trata de un fármaco cuyo componente principal es el extracto de frutos rojos, rico en antocianinas que juegan un importante papel en la función visual(42). Estudios recientes en humanos han mostrado una reducción significativa de la progresión miópica y del alargamiento axial con el tratamiento durante 1 año con Difrarel en niños con alta miopía con respecto al grupo control. El efecto del fármaco fue consistente después de su interrupción durante 1 año(43). Previamente en estudios experimentales con animales se había comprobado que el Difrarel oral inhibía la elongación axial en animales con miopía inducida por depravación(44).
4. ¿Qué debe hacer el oftalmólogo?
Actualmente no existe un protocolo establecido que establezca las diferentes medidas que el oftalmólogo debe de seguir para tratar de controlar la progresión miópica de sus pacientes. Recientemente Schittkoswki et al, basándose en los resultados de los estudios ATOM 1 y ATOM2, publicaron una guía práctica sobre la posología de la atropina al 0.01% en el tratamiento de la miopía(45). Las pautas que proponen de forma resumida son las siguientes (Figura 2):
- Dosis, horario: 1 gota de atropina al 0.01% al día en cada ojo en el fornix inferior a la hora de acostarse.
- ¿A quién y cuándo tratar?: niños con edad ≥ 6 años con una miopía de ≤- 2 dioptrías (equivalente esférico, refracción bajo cicloplejia) que haya progresado más de -0.50 D en el último año. Aunque no se ha demostrado la eficacia de la atropina en niños mayores de 12 años parece razonable tratar a aquellos adolescentes cuya miopía siga progresando. No recomiendan tratar a niños menores de 6 años ya no hay estudios que evalúen la eficacia y seguridad en menores de esta edad.
- Duración del tratamiento: el tratamiento con atropina al 0.01% debe durar 2 años, ya que la eficacia es mayor durante el segundo año de tratamiento(38). Después del período de 2 años, la administración de la atropina debe interrumpirse si la tasa de progresión de la miopía es más lenta que -0.25D/año durante el segundo año. Por el contrario, una tasa de progresión de la miopía más rápida que -0.5 D / año justificaría una reanudación del tratamiento.
- Seguimiento:
- Durante el tratamiento: cada 6 meses evaluando la refracción bajo cicloplejia y realizando medición de la longitud axial, evaluando también la eficacia, adherencia al tratamiento y detectando los posibles efectos adversos.
- Tras suspender el tratamiento también son necesarios revisiones periódicas para detectar cualquier rebote. La terapia con atropina se reanuda si la progresión es de nuevo superior a -0.5 D / año.
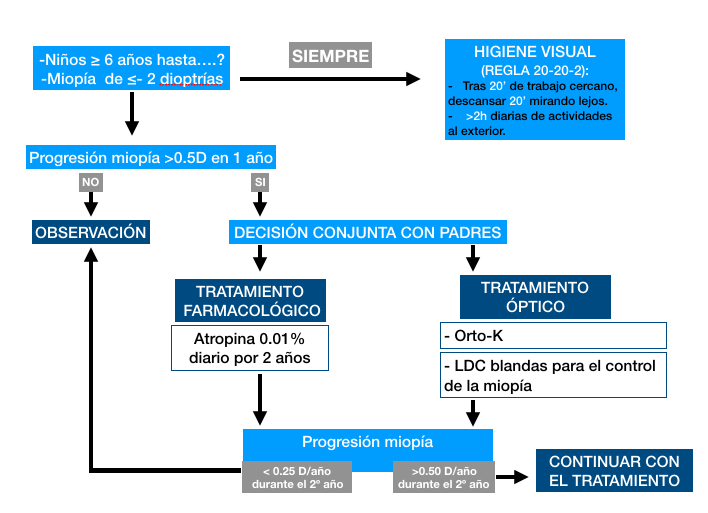
Figura 2. Resumen de las pautas de tratamiento propuestas por Schittkoswki et al(45).
Bibliografía
- Dolgin, E. The myopia boom. Nature 2015, 519, 276–278.
- Delcourt, C.; Korobelnik, J.F.; Buitendijk, G.H.; Foster, P.J.; Hammond, C.J.; Piermarocchi, S.; Peto, T.; Jansonius, N.; Mirshahi, A.; Hogg, R.E.; et al. Ophthalmic epidemiology in Europe: The “European Eye Epidemiology” (E3) consortium. Eur. J. Epidemiol. 2016, 31, 197–210.
- Liang CK, Ho TY, Li TC, et al. A combined therapy using stimulating auricular acupoints enhances lower-level atropine eyedrops when used for myopia control in school-aged children evaluated by a pilot randomized controlled clinical trial. Complement Ther Med. 2008;16(6):305-310.
- HoldenBA,FrickeTR,WilsonDA,etal.Global prevalence of myopia and high myopia and temporal trends from 2000 through 2050. Ophthalmology. 2016;123(5):1036-1042.
- Kennedy RH, Dyer JA, Kennedy MA, et al. Reducing the progression of myopia with atropine: a long term cohort study of Olmsted County students. Binocul Vis Strabismus Q. 2000;15(3)(suppl):281-304.
- Goss, D.A. Variables related to the rate of childhood myopia progression. Optom. Vis. Sci. 1990, 67, 631–636.
- United Nations. World Population Ageing 2017. Available at: http://www. un.org/en/development/desa/population/publications/pdf/ageing/WPA2017_ Report.pdf. Accessed September 20, 2018.
- Zhang, X.; Qu, X.; Zhou, X. Association between parental myopia and the risk of myopia in a child. Exp. Ther. Med. 2015, 9, 2420–2428.
- Verhoeven, V.J.; Hysi, P.G.; Wojciechowski, R.; Fan, Q.; Guggenheim, J.A.; Hohn, R.; MacGregor, S.; Hewitt, A.W.; Nag, A.; Cheng, C.Y.; et al. Genome-wide meta-analyses of multiancestry cohorts identify multiple new susceptibility loci for refractive error and myopia. Nat. Gen. 2013, 45, 314–318.
- Smith EL 3rd, Hung LF, Arumugam B. Visual regulation of refractive development: insights from animal studies. Eye (Lond). 2014; 28:180–188.
- Morgan IG, French AN, Ashby RS, et al. The epidemics of myopia: aetiology and prevention. Prog Retin Eye Res. 2018; 62:134–149.
- He M, Huang W, Zheng Y, et al. Refractive error and visual impairment in school children in rural southern China. Ophthalmology. 2007; 114:374–382.
- Xiong, S.; Sankaridurg, P.; Naduvilath, T.; Zang, J.; Zou, H.; Zhu, J.; Lv, M.; He, X.; Xu, X. Time spent in outdoor activities in relation to myopia prevention and control: A meta-analysis and systematic review. Acta Ophthalmol. 2017, 95, 551–566.
- Rose, K.A.; Morgan, I.G.; Ip, J.; Kifley, A.; Huynh, S.; Smith, W.; Mitchell, P. Outdoor activity reduces the prevalence of myopia in children. Ophthalmology 2008, 115, 1279–1285.
- Verhoeven, V.J.; Buitendijk, G.H.; Rivadeneira, F.; Uitterlinden, A.G.; Vingerling, J.R.; Hofman, A.; Klaver, C.C.W. Education influences the role of genetics in myopia. Eur. J. Epidemiol. 2013, 28, 973–980.
- Morgan, I.G.; Rose, K.A. Myopia and international educational performance. Ophthalmic Phys. Opt. 2013, 33, 329–338.
- Williams, K.M.; Bertelsen, G.; Cumberland, P.; Wolfram, C.; Verhoeven, V.J.; Anastasopoulos, E.; Buitendijk, G.H.; Cougnard-Grégoire, A.; Creuzot-Garcher, C.; Erke, M.G.; et al. Increasing Prevalence of Myopia in Europe and the Impact of Education. Ophthalmology 2015, 122, 1489–1497.
- Mahayana, I.T.; Indrawati, S.G.; Pawiroranu, S. The prevalence of uncorrected refractive error in urban, suburban, exurban and rural primary school children in Indonesian population. Int. J. Ophthalmol. 2017, 10, 1771–1776.
- Smith EL 3rd, Hung LF, Arumugam B. Visual regulation of refractive development: insights from animal studies. Eye (Lond). 2014; 28:180–188
- Queiros, A.; Gonzalez-Meijome, J.M.; Jorge, J.; Villa-Collar, C.; Gutierrez, A.R. Peripheral refraction in myopic patients after orthokeratology. Optom Vis. Sci. 2010, 87, 323–329.
- Mathur, A.; Atchison, D.A. Effect of orthokeratology on peripheral aberrations of the eye. Optom. Vis. Sci. 2009, 86, E476–E484.
- Cho, P.; Cheung, S.W. Discontinuation of orthokeratology on eyeball elongation (DOEE). Cont. Lens Anterior Eye 2017, 40, 82–87.
- Hsiao, C.H.;Lin,H.C.;Chen,Y.F.;Ma,D.H.;Yeh,L.K.;Tan,H.Y.;Huang,S.C.M.;Lin,K.K. Infectious keratitis related to overnight orthokeratology. Cornea 2005, 24, 783–788.
- Hoddenbach, J.G.; Boekhoorn, S.S.; Wubbels, R.; Vreugdenhil, W.; Van, R.J.; Geerards, A.J. Clinical presentation and morbidity of contact lens-associated microbial keratitis: A retrospective study. Graefes. Arch. Clin. Exp. Ophthalmol. 2014, 252, 299–306.
- Anstice, N.S.; Phillips, J.R. Effect of dual-focus soft contact lens wear on axial myopia progression in children. Ophthalmology 2011, 118, 1152–1161.
- Cheng, X.; Xu, J.; Chehab, K.; Exford, J.; Brennan, N. Soft contact lenses with positive spherical aberration for myopia control. Optom. Vis. Sci. 2016, 93, 353–366.
- Sankaridurg, P.; Holden, B.; Smith, E., 3rd; Naduvilath, T.; Chen, X.; de la Jara, P.L.; Martinez, A.; Kwan, J.; Ho, A.; Frick, K.; et al. Decrease in rate of myopia progression with a contact lens designed to reduce relative peripheral hyperopia: One-year results. Investig. Ophthalmol. Vis. Sci. 2011, 52, 9362–9367.
- Walline, J.J.; Gaume, A.; Jones, L.A.; Rah, M.J.; Manny, R.E.; Berntsen, D.A.; Chitkara, M.; Kim, A.; Quinn, N. Benefits of contact lens wear for children and teens. Eye Contact Lens 2007, 33, 317–321.
- Li, L.; Moody, K.; Tan, D.T.; Yew, K.C.; Ming, P.Y.; Long, Q.B. Contact lenses in pediatrics study in Singapore. Eye Contact Lens 2009, 35, 188–195.
- Walline, J.J.;Lindsley,K.;Vedula,S.S.;Cotter,S.A.;Mutti,D.O.;Twelker,J.D. Interventions to slow progression of myopia in children. Cochrane Database Syst. Rev. 2011, CD004916.
- Fischer, A.J.;McGuire,J.J.;Schaeffel,F.;Stell,W.K.Light-andfocus-dependent expression of the transcription factor ZENK in the chick retina. Nat. Neurosci. 1999, 2, 706–712.
- Bedrossian RH. The effect of atropine on myopia. Ophthalmology. 1979;86: 713–719.
- Bedrossian RH. The treatment of myopia with atropine and bifocals: a long- term prospective study. Ophthalmology. 1985; 92:716.
- McBrien NA, Moghaddam HO, Reeder AP. Atropine reduces experimental myopia and eye enlargement via a non accommodative mechanism. Invest Ophthalmol Vis Sci. 1993; 34:205–215.
- Chua, W.H.; Balakrishnan, V.; Chan, Y.H.; Tong, L.; Ling, Y.; Quah, B.L.; Tan, D. Atropine for the treatment of childhood myopia. Ophthalmology 2006, 113, 2285–2291.
- Chia, A.;Chua,W.H.;Cheung,Y.B.;Wong,W.L.;Lingham,A.;Fong,A.;Tan,D. Atropine for the treatment of childhood myopia: Safety and efficacy of 0.5%, 0.1%, and 0.01% doses (Atropine for the Treatment of Myopia 2). Ophthalmology 2012, 119, 347–354.
- Polling, J.R.;Kok,R.G.;Tideman,J.W.;Meskat,B.;Klaver,C.C.Effectiveness study of atropine for progressive myopia in Europeans. Eye (Lond.) 2016, 30, 998–1004.
- Chia, A.;Lu,Q.S.;Tan,D. Five-Year Clinical Trial on Atropine for the Treatment of Myopia2: MyopiaControl with Atropine 0.01% Eyedrops. Ophthalmology 2016, 123, 391–399.
- Tong L, Huang XL, Koh AL, et al. Atropine for the treatment of childhood myopia: effect on myopia progression after cessation of atropine. Ophthalmology. 2009; 116:572–579.
- Chia A, Chua WH, Wen L, et al. Atropine for the treatment of childhood myopia: changes after stopping atropine 0.01%, 0.1% and 0.5%. Am J Ophthalmol. 2014; 157:451–457.e1.
- Kothari, M.;Rathod,V. Efficacy of 1% atropine eye drops in retarding progressive axial myopia in Indian eyes. Indian J. Ophthalmol. 2017, 65, 1178–1181.
- Kamiya K, Kobashi H, Fujiwara K, Ando W, Shimizu K. Effect of fermented bilberry extracts on visual outcomes in eyes with myopia: a prospective, randomized, placebo-controlled study. J Ocul Pharmacol Ther. 2013;29(3):356–359.
- Omar IAN. Effect of bilberry extract on slowing high-myopia progression in children: 2-year follow-up study. Clin Ophtalmolo.2018; 12:2575-2579. Publishe 2018 Dec 12. doi: 10.2147/OPTH.S187949.
- Deng HW, Tian Y, Zhou XJ, Zhang XM, Meng J. Effect of bilberry extract on development of form-deprivation myopia in the guinea pig. J Ocul Pharmacol Ther. 2016;32(4):196–202.
- Schittkowski,M.P.; Sturm,V. Atropine for the prevention of progression in myopia -data, side effects, practical guidelines. Klin. Monbl. Augenheilkd 2017, 235, 385–391.
- Yam JC, Jiang Y, Tang SM, et al. Low-Concentration Atropine for Myopia Progression (LAMP) study: a randomized, doubleblinded, placebo-controlled trial of 0.05%, 0.025%, and 0.01% atropine eye drops in myopia control. Ophthalmology. 2019;126:113e124.
AUTOR

Natalia Monja Alarcón
– Residente Hospital Universitario de Fuenlabrada, Madrid.
COAUTOR

Nuria Pfeiffer Vicens
– Residente Hospital Universitario de Fuenlabrada, Madrid.
Imagen de portada: Karolina Grabowska en pexels.com

1 Comentarios