Espectro lumínico y oftalmología: Controversias con el filtro azul y otras patologías
Antecedentes
Históricamente, y según la Biblia, San Pablo alrededor del año 30 al 50 d.c, se quedó temporalmente ciego al mirar al sol, con una recuperación total a los 3 días(1); en el siglo XVII, Galileo observó que la mirada prolongada y directa al sol podría causar aberraciones visuales.(2)
En la década del 1940 se empezaron a desarrollar investigaciones de peso, sobre los efectos de la luz solar en la retina.(3,4,5) Los trabajos en modelos de animales y cultivo celular, demostraron que las longitudes de onda de la porción azul del espectro electromagnético, 400-500 nanómetros (nm), podía inducir fototoxicidad retiniana.(6–9)
Introducción
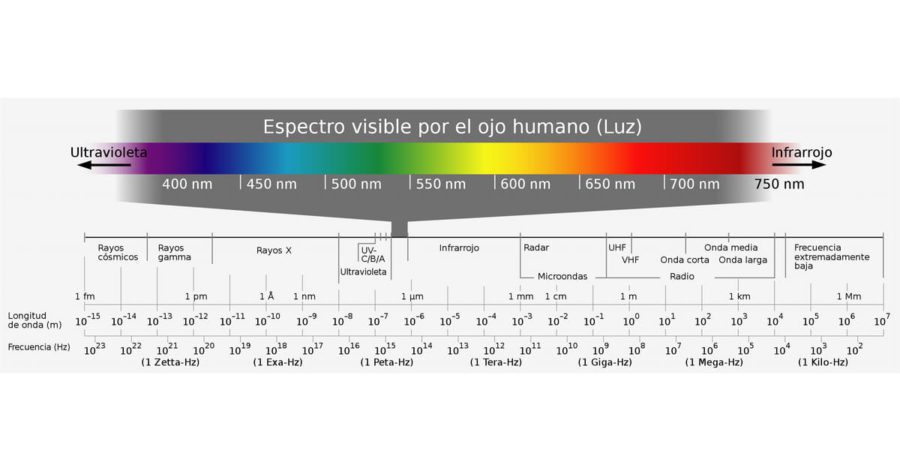
La radiación de luz emitida por el sol que llega a la tierra abarca un espectro que comprende desde los 100 a los 2300 nm. El pico se encuentra en el rango amarillo-verde (480-550 nm), con una fuerte disminución de la luz infrarroja y ultravioleta (UV). Las porciones más ofensivas del espectro electromagnético son la radiación UV (200-400 nm) y la porción de luz azul del espectro visible (400-500 nm). De forma más precisa, la porción de luz azul comprende, la luz violeta (400-440 nm) y la luz azul propiamente dicha (440-500 nm). Los rayos UV-A (315-400 nm), la luz visible (380-760 nm, incluyendo la violeta, 400-440 nm, y la azul, 440-500 nm) y los infrarrojos (> 760 nm) pueden alcanzar la superficie terrestre. Afortunadamente, la atmósfera absorbe casi toda la luz UV-C (100-280 nm) y la mayor parte de la luz UV-B (280-315 nm).(10–13)
La irradiancia solar, definida como potencia por unidad de área (Wm-2), es la medida de la radiación del sol en una longitud de onda específica. La atmósfera, en promedio, atenúa la irradiancia solar en un 30%(5,14,15,16). Arnault y cols, observaron que aproximadamente el 15% de la irradiancia de luz solar llega a la retina. Además, confirmaron la transmisión óptica únicamente entre las longitudes de onda de 450-700 nm.(5,17)
La luz que incide sobre la retina depende de la entrada óptica del entorno, transmitiéndose a través de los medios oculares a varios pigmentos visuales dentro de la retina.(5,18,19) Los tres pigmentos de fotorreceptores de conos tienen absorciones máximas a 420, 534 y 563 nm, constituyendo un rango entre los 400 y 700 nm (espectro visible). La córnea es la responsable de absorber y filtrar la radiación UV más corta, que además es, la más energética UV-C, < 280 nm).(5,18,19,20,21,22) El humor acuoso absorbe una cantidad moderada de luz entre los 280-360 nm, y luz en rango infrarrojo de longitud larga (1200-2300 nm).(5,18,19,20,21,22,23) Conforme la luz viaja a través del cristalino hacia la cámara vítrea, se produce la absorción más sustancial de radiación UV.(5,18,19,20,21) Un cristalino joven absorberá principalmente UV-A (315-400 nm), mientras que un cristalino más adulto también impedirá la transmisión de UV-B (280-315 nm).(5,18,19,20,21,22,23)
En definitiva, la luz ambiental que llega a la retina está compuesta por infrarrojos (700-1200 nm), espectro visible (400-700 nm) y en personas jóvenes, UV-B (280-315 nm).(5,18,19,20,21,22,23)
Relación luz azul-daño retiniano
Las longitudes de onda más cortas, se asocian con un daño celular más intenso, inicialmente a nivel del epitelio pigmentario de la retina (EPR), con un pico alrededor de los 440 nm en ojos fáquicos.(7)
La razón fundamental para introducir filtros de luz azul fue mitigar el riesgo de toxicidad retiniana, atenuando la luz visible de longitud de onda corta, fundamentalmente en el rango de 400 nm a 500 nm.
Sin embargo, las posibles desventajas de bloquear la transmisión de luz visible de longitud de onda corta son las siguientes(7,11):
- Alteraciones de la percepción del color
- Disminución de la sensibilidad escotópica
- Alteraciones de la sincronización del sistema circadiano
Las principales fuentes de luz azul ambiental son:(24)
- Luz solar (fuente predominante)
- Fuentes incandescentes tradicionales
- Diodos emisores de luz de alta intensidad (LEDs)
- Lámparas fluorescentes compactas (CFL)
Estas dos últimas son preocupantes, por los altos niveles de luz visible de onda corta que emiten.(24)

Los LED de luz blanca, son los más utilizados en las pantallas retroiluminadas de los teléfonos inteligentes y las tablets. Sin embargo, y aunque la luz emitida por estos LED parece blanca, muestran un espectro de emisiones máximas en longitudes de onda correspondientes al «pico peligroso» de luz azul (440-500 nm). Además, se ha observado que la exposición de las células del EPR cultivadas a una luz equivalente a la de los dispositivos móviles provoca un aumento de la producción de radicales libres y una reducción de la viabilidad celular.(24)De manera que han surgido preocupaciones acerca de que la exposición acumulativa a la luz azul de estas fuentes, pudiera inducir toxicidad retiniana y aumentar potencialmente el riesgo de desarrollar degeneración macular asociada a la edad (DMAE).(24,25,26,27)
La Comisión Internacional de Protección contra Radiaciones No Ionizantes (ICNIRP), ha informado de los límites de seguridad para la exposición ocular humana a la radiación óptica(24,28). De esta manera, las fuentes de iluminación modernas(pantallas de ordenadores, tablets y teléfonos), presenta un nivel de emisión de luz azul unas 100 veces inferior al nivel que podría ser peligrosa para el ojo, según se especifica en las pautas de ICNIRP.
El riesgo de daño retiniano secundario a la luz azul emitida por dispositivos digitales y fuentes de luz doméstica es mínimo, incluso en condiciones de visualizaciones extremas a largo plazo.(24,28)
Retinopatía solar
La retinopatía solar es consecuencia de una mayor exposición de la retina a la radiación UV.(29,30) La retinitis foveomacular(31), como tradicionalmente se conocía a esta entidad, se empleaba para describir una afección que imitaba oftalmológicamente a la retinopatía solar, pero que carecía teóricamente de factores desencadenantes conocidos; esta entidad, se describió en militares que no recordaban haber estado mirando al sol. Wergeland y Brenner,(32) demostraron notables similitudes entre las 2 entidades anteriores, llegando posteriormente a la conclusión de que, en realidad, eran la misma.
Efectos del exceso de luz en la retina
A pesar de existir mecanismos, para limitar la radiación UV que llega a la retina, estos fallan al mirar directa y detenidamente al sol, al igual que ocurre en otros escenarios (soldadores, trastornos psiquiátricos, como la esquizofrenia); esto es debido a la luz de alta energía (UV-B) y a la exposición prolongada.(5,33)
La luz produce daños a través de 3 mecanismos:
- Fotoquímico
- Fotomecánico
- Fototérmico
El principal componente de daño a la retina, es la vía fotoquímica, mientras que las otras dos vías, tienen una contribución menor, ya que la deposición de energía por la luz UV es muy baja para generar un aumento de la temperatura, y por lo tanto, se generan ondas de presión termoelásticas mínimas.(2,34)
Existen 2 mecanismos de daño fotoquímico (conocidos como daño Noell y daño Ham).(7–9)
- El daño Noell o Clase I. Se produce por una disrupción en los fotorreceptores, seguida por el EPR (490-580 nm).
- El daño Ham o Clase II. Se produce por una disrupción iniciada a nivel del EPR, que conduce a una respuesta histológica con hipopigmentación en 48 horas, tras la exposición, más corta, a luz de alta intensidad (entre 10 s y 2 h de duración; y 30,60 y 90 J/cm2 de intensidad, siendo 30 J/cm2, el umbral paramacular); y con longitudes de onda comprendidas entre 6 y 441 nm.
La radiación UV genera daño químico,muy uniforme en el área irradiadapor diferentes tipos de mecanismos, incluida la producción de radicales libres y la toxicidad dependiente del oxígeno.(3–39) Al incidir la radiación, excitan y regresan al estado fundamental a los electrones, con la producción de especies reactivas de oxígeno, con la consiguiente peroxidación de lípidos y finalmente produciendo daño tisular.(2,35) Además, la lipofuscina del EPR, es muy fotorreactiva, contribuyendo en parte a la toxicidad lumínica.(2,37) En un estudio in vitro, con células alimentadas con lipofuscina, se observaron que aquellas células expuestas a luz UV (390-550 nm), presentaron niveles aumentados de peroxidación de lípidos y proteínas, con la subsiguiente muerte celular; sin embargo, no se observaron consecuencias adversas bajo estimulación con luz visible (550-800 nm).(2,36) Las capas externas de la retina central son las más sensibles al daño fotoquímico, siendo las anomalías más comunes, la rotura de las células del EPR y el daño del segmento externo de los fotorreceptores.(2,36,37)
La desnaturalización térmica, que produce una destrucción mayor en el centro y luego se reduce hacia la periferia,(38) es el mecanismo principal de las lesiones retinianas, como consecuencia de la radiación solar.(2) Se ha demostrado una maculopatía térmica, por un potente aumento de temperatura en el EPR y la coroides, en conejos expuestos a la luz solar concentrada.(2,39) Sin embargo, los efectos fototérmicos de la radiación UV no contribuyen de manera significativa a la retinopatía UV, ya que los melanosomas del EPR y los melanocitos en la coroides, absorben gran parte de la energía entrante permitiendo una rápida disipación del calor.(2,35)
El efecto fotomecánico, causa daños a través de ondas de choque por una rápida inducción de energía en los melanosomas del EPR.(40) Sin embargo, existe poco daño tisular, puesto que los factores importantes para este daño son la velocidad de entrega y la cantidad de energía absorbida, y no la longitud de onda.(2,40) Además, el daño se ocasiona por una irradiancia extremadamente alta, que es muy rara con la luz solar y el uso de láser.(2,40)
Etiología de la retinopatía solar
-Eclipses solares-
La duración de la exposición es fundamental para el desarrollo de las lesiones retinianas. La mirada al sol de simplemente 1 minuto, puede producir una maculopatía con una lesión foveal aguda.(2,34)
-Soldadores-
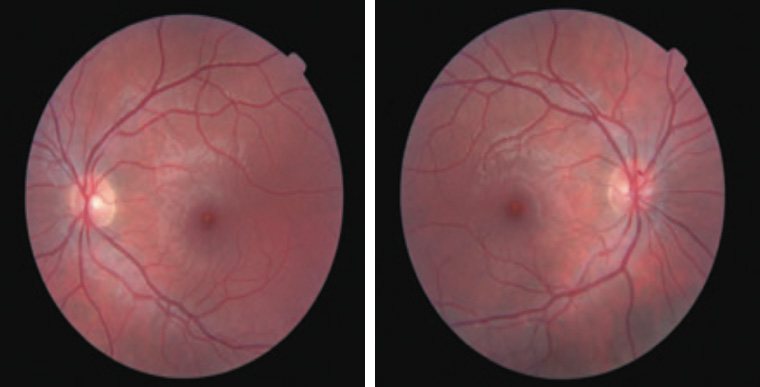
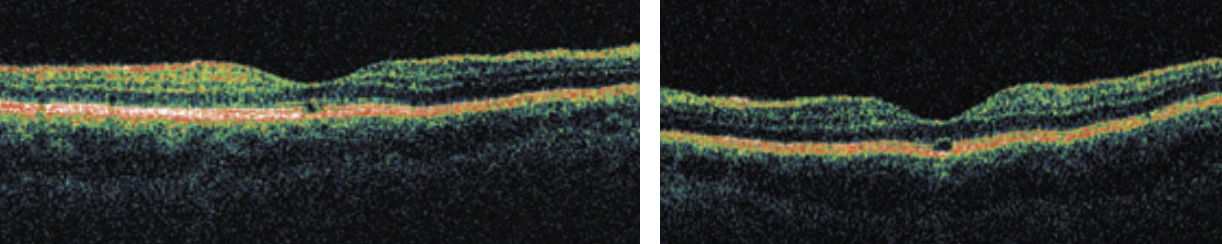
La queratitis UV (del soldador”), se asocia con dolor y sensación de cuerpo extraño.(2,41,42,43) Habitualmente, y de forma posterior, se produce una maculopatía fototóxica, con escotomas centrales y metamorfopsias, que pueden llegar a ser permanentes.(2,43). Un ejemplo de ello es el caso descrito de un hombre joven de 21 años, que se presentó 3 días después, en consulta de oftalmología, por una sobreexposición mientras soldaba (soldando con máscara pero sin la visera bajada); cuatro años después sufrió una lesión foveal fototóxica, con una agudeza visual corregida de 6/12 en ambos ojos; en el fondo de ojo se observaba una hipopigmentación del EPR subfoveal y en la OCT, una disrupción del centro foveal con ausencial de EPR y fotorreceptores (ver figuras 1 y 2).(44) La incidencia de maculopatía fototóxica es incierta, pero se estima que en torno al 0.14-15 % de los casos, se produce en el contexto de soldaduras.(44) Existe un gran debate sobre si la maculopatía por soldadura, es una enfermedad profesional o un accidente de trabajo.(2,44,45)
-Exposición ocular involuntaria-
Mirar al sol involuntariamente, puede provocar efectos fototóxicos en la retina.(2,46) Es más, la simple exposición solar en parques comunitarios o playas, puede conducir a déficits visuales permanentes.(2,46)
-Trastornos psiquiátricos y drogas-
Paciente con esquizofrenia, presentan en ocasiones, una exposición prolongada al sol, asociado a veces con la oración;(2,47,48) igualmente se han descrito, casos de pacientes con trastorno bipolar, en fase maniaca, con deterioro progresivo de la visión, por la exposición solar.(2,49)
Se han descrito una amplia gama de efectos biológicos, con el consumo de LSD, cocaína, metilfenidato y cannabis, entre ellos, una mayor conciencia de las imágenes visuales, atracción por objetos brillantes y coloridos. Además, el LSD, produce midriasis, y conduce a una mayor irradiancia de la luz que se propaga a la retina.(2,50,51,52,53)
-Láseres-
Los efectos adversos de los sistemas láser usados en la práctica clínica habitual son raros, la mayoría de ellos relacionados con quemaduras térmicas de la córnea durante la fotocoagulación de la retina.(54,55)
Se han descrito quemaduras maculares por la exposición a láseres de Nd:Yag, helio-neón, rubí y de CO2.(56)
Los punteros láser de mano, puede generar un daño potencial en la retina, fundamentalmente por una lesión térmica. La mayoría de ellos, operan en el espectro visible e infrarrojo próximo (sin emisión UV).(57)
Los láseres azul y violeta emiten luz de espectro visible/UV próximo (450 nm) con un rango de potencia de 150-1200 mW. Una serie de casos consecutivos en Arabia Saudita documentó la exposición al láser azul en 14 hombres, causando agujeros maculares de espesor total, hemorragias retinianas y alteración de las capas de la retina.(58)
Presentación clínica
La exposición prolongada a la radiación UV produce, de forma unilateral o bilateral (la exposición solar, habitualmente produce un daño retiniano bilateral), visión borrosa, cefalea frontal, cromatopsia, metamorfopsias y escotomas centrales o paracentrales; con una AV de cuenta dedos (CD) en casos graves, pero generalmente varía entre 20/30-20/60.(59,60)
Tras la agresión, se observa comúnmente un edema macular marcado, y se resuelve en 2-3 días, apareciendo en la fóvea central una mancha de color blanco amarillento con pigmento oscuro circundante, en un patrón moteado, y finalmente evoluciona a una marca circular roja, bien delimitada.(61,62,63)
Pruebas de imagen
La OCT es la prueba de imagen gold standard para detectar cambios sutiles en la retinopatía inducida por UV.(2,64,65)
En las etapas agudas, los hallazgos comunes son áreas hiperreflectantes en las capas foveales, cambios en la reflectancia por la participación de fotorreceptores, y disminución de la intensidad de reflectancia en EPR.(30,64,65)
La angiografía fluoresceínica (AGF), en pacientes con retinopatía UV, con frecuencia se encuentra dentro de los límites normales, aunque algunos trabajos presentan casos de defectos de ventana y fugas parafoveales. Freedman y Gombos, detectaron roturas en la membrana de Bruch y deterioro completo del EPR.(61,66,67)
La autofluorescencia (AF), en fase aguda de la retinopatía UV, presenta áreas de hipoautofluorescencia (defectos en la unión del segmento interno/externo de los fotorreceptores), circunscritos por una leve hiperautofluorescencia.(68,69) En casos crónicos, la AF revela un aumento de la autofluorescencia macular y grupos de manchas hipoautofluorescentes suprafoveales.(70)
Secuelas crónicas
Afortunadamente, la mayoría de los pacientes con retinopatía UV no sufren consecuencias a largo plazo y la AV vuelve a los valores iniciales previos a la exposición.(2)
Se ha investigado la exposición a la luz solar como factor de riesgo de DMAE, y aunque la evidencia experimental parecía suficiente, la evidencia epidemiológica era inestable, sin llegar a una conclusión definitiva, sin evidencia moderada de una asociación entre las dos.(71,72,73) Sin embargo, fue en el 2014, cuando se publicó el primer meta-análisis, que revisó los estudios publicados hasta la fecha, para determinar la relación entre la exposición solar y la DMAE, dirigidos por Sui y cols; se informó de una razón de probabilidades de 1.38, indicando que una exposición crónica a la luz solar, aumentaba el riesgo de DMAE.(74) Además, se hizo un análisis de subgrupos mostrando un aumento adicional en el riesgo de DMAE, en poblaciones con una renta per cápita más baja, con una disminución significativa de la odds ratio, conforme aumentaba el PIB per cápita.(74)
Medidas preventivas
La radiación UV en la retina puede tener consecuencias destructivas, de manera que la acción fundamental es una protección solar adecuada, para personas que trabajan con mucha luz.(2) Según la Academia Americana de Oftalmología, ciertos tipos de material para lentes (carbonato, policarbonato), sumado a una capa de protección antirreflectante o UV, tienen la capacidad de bloquear y reducir los rayos UV, que llegan a la retina.(74,75)
Los filtros y películas son alternativas seguras para la visualización de eclipses solares; la adición de plata, aluminio o cromo, conduce a una atenuación considerable de la energía UV, visible e infrarroja.(76)
Los filtros, vidrio de soldador de arco del número 12 al 14 y el Mylar aluminizado (película de poliéster hecha de tereftalato de polietileno) son opciones que se puede adaptar a una caja o dispositivo de visualización.
Los filtros inseguros incluyen vidrio ahumado, filtros de densidad neutra, filtros polarizados y filtros solares.(77)
La única película segura para la visualización de eclipses solares, es una película plateada en blanco y negro completamente expuesta y revelada.(76)
Las personas con mayor riesgo de sufrir los efectos fototóxicos de la radiación UV son:(40,78,79,80,81,82)
- Trabadores con exposición a la luz solar y UV alta (militares, marineros, soldadores…)
- Afáquicos. Son los más susceptibles, ya que carecen de capacidad endógena para absorber la luz UV peligrosa
- Pseudofáquicos
Para estos grupos de personas, Adrian(81), Fishman(82) y Ham(40), sugieren el uso de gafas con filtros para el espectro UV, 300-400 nm, y protectores laterales, para minimizar la dispersión de la luz incidente oblicua, especialmente en los casos de afaquia.
Si bien en seres humanos, los antioxidantes parecen reducir el riesgo de progresión de la DMAE y muestran algún beneficio en modelos animales de fototoxicidad, se desconoce si la suplementación con antioxidantes después de una exposición aguda, podría mejorar la recuperación visual; aunque probablemente los antioxidantes confieren una ventaja protectora contra la exposición a los rayos UV.(2) La vitamina C o ácido ascórbico, podría brindar protección a la retina del daño inducido por la luz, como se ha demostrado en los estudios en ratas, mostrando una reducción de la pérdida de fotorreceptores y EPR.(82,83) Sin embargo, son necesarios ensayos clínicos en humanos.
Manejo tras la exposición aguda
No se dispone actualmente de pautas, para el uso de corticoesteroides en el tratamiento de la retinopatía UV aguda, pero se han empleado corticoesteroides sistémicos por sus efectos potentes antiinflamatorios.(84)
Se piensa que la metilprednisolona inhibe la peroxidación lipídica, y podría atenuar el daño retiniano inducido por la luz. Los resultados parecen ser beneficiosos, al demostrar la resolución del edema macular, pero también se ha observado la resolución espontánea del mismo; además, los pacientes con corticoesteroides sistémicos tienen un amplio rango de AV final, desde la resolución completa hasta el deterioro duradero con escotomas.(84,85)
En definitiva, los beneficios de los corticoesteroides se limitan a una ventana precoz tras la exposición a la luz y los oftalmólogos deben sopesar el uso de los mismos, teniendo en cuenta los riesgos-beneficios.(84,85,86)
Medidas protectoras
- Gafas con filtro azul
En la sociedad actual, son frecuentes los síntomas astenópicos (fatiga visual, dolores de cabeza, malestar ocular, ojo seco, diplopía y visión borrosa), por la gran cantidad de horas al día, que la mayoría de las personas dedican a leer textos, en dispositivos electrónicos a distancias cortas de trabajo; además, existen otras causas coadyuvantes, tales como los errores refractivos no corregidos, trastornos oculomotores, anomalías de la película lagrimal etc.(7) En definitiva, es muy complicado descifrar el papel que desempeña la luz azul en estos síntomas.(87–91)
A diferencia del interés suscitado por el empleo de LIO con filtro azul, las lentes para gafas que bloquean la luz azul han recibido poca atención científica(7) aunque mucha atención comercial.
El empleo de lentes con filtros estándar para gafas, generalmente ofrecen protección contra los rayos UV, hasta longitudes de onda de 380 nm, y la adición de un cromóforo amarillo también puede reducir o eliminar la transmisión de luz azul.(7,12,13) Además, se pueden aplicar revestimientos de interferencia antirreflejos tanto en la superficie anterior como en la posterior del cristal, para abordar selectivamente partes del espectro de luz azul-violeta (415-455 nm).(7,12)
Las lentes de las gafas con bloqueo azul (440-500 nm), que atenúan la luz de longitud de onda corta (del 10 al 100%), se comercializan entre la población por una serie de supuestos beneficios:(7,11,12,13,14)7,11,12,13,14
- Aliviar la fatiga visual (en particular cuando se usan ordenadores y otros dispositivos digitales)
- Mejorar la calidad del sueño
- Por conferir una posible protección frente a la fototoxicidad retiniana
Sin embargo, en una revisión sistemática, donde se investigaron los beneficios relativos y los daños potenciales de las gafas con filtro azul, se encontró una falta de evidencia de alta calidad que apoye el uso de gafas con cristales con filtro azul en la población general, para mejorar el rendimiento visual o la calidad del sueño, aliviar la fatiga ocular o conservar la salud macular.(7)
Además, las posibles desventajas de bloquear la transmisión de luz visible de longitud de onda corta incluyen, alteraciones en la percepción del color, disminución de la sensibilidad escotópica (que conduce a un peor rendimiento en condiciones de luz tenue) y alteración de la sincronización del sistema circadiano. Recordar brevemente, que el ritmo circadiano, está mediado por las células ganglionares retinianas intrínsecamente fotosensibles (ipRGC), que contienen melanopsina (fotopigmento que es sensible a las longitudes de onda cortas, fundamentalmente el espectro alrededor de los 480 nm); los axones se proyectan hacia el núcleo supraquiasmático del hipotálamo y regulan la secreción de melatonina por la glándula pineal, con un pico de producción a 464 nm; de manera que, las células ganglionares retinianas intrínsecamente fotosensibles, que proporcionan entrada al reloj circadiano central en el núcleo supraquiasmático, expresan melanopsina y tienen un pico de absorción a aproximadamente 480 nm en la parte azul del espectro.(7) Por consiguiente, una lente con bloqueo de luz azul, conseguiría el efecto contrario, alterando el ritmo circadiano y secundariamente la calidad del sueño.
Además, en uno de los trabajos incluídos en esta revisión sistemática, se encontró una mejoría en 3 ítems del cuestionario empleado (dolor alrededor o dentro del ojo, pesadez ocular y picor en los ojos), en el grupo de lentes con filtro alto de luz azul, tras el uso de dispositivos digitales; sin embargo, no especificaron si este análisis fue pre-especificado o fue parte de una comparación post-hoc.(88)
La frecuencia crítica de fusión (CFF), es la frecuencia en la cual una luz que centellea parece detenerse o un punto luminoso fusionado comienza a centellear; se trata de una medida sensitiva para evaluar recuperación de anestesia, efecto de medicamentos, estados afectivos y fatiga. En un ensayo clínico aletarorizado (ECA), se informa de que las lentes con filtro alto de luz azul, producen una reducción menos pronunciada de la CFF, donde se empleó como un indicador de fatiga ocular.(89) Sin embargo, esto no queda claro, ya que se ha demostrado que la CFF disminuye tras la lectura, independientemente de si la tarea se realiza en papel o dispositivo electrónico. En definitiva, este parámetro probablemente sea independiente de la exposición a la luz azul.
Además, al examinar la evidencia disponible sobre la influencia de las lentes con filtro azul, en la calidad del sueño, se obtuvieron los siguientes resultados:
- Las gafas con filtro de bloqueo alto para la luz azul (60%), se asocian con una mejora en la calidad del sueño, al compararlos con el grupo de filtro de bloqueo bajo para luz azul (24.2%).(7)
- Leung et al, no encuentran diferencias significativas en el efecto de las lentes con bloqueo alto o bajo de luz azul, sobre la calidad del sueño.(92)
- Burkhart y Phelps, observaron que los pacientes que usaban las gafas con bloqueo tanto alto como bajo de luz azul, presentaban dificultad para reconciliar el sueño durante 3 horas, en un período de 2 semanas.(93)
- No hay estudios que informen sobre los efectos del filtro de luz azul en las gafas, sobre la salud macular. A pesar de los riesgos probables secundarios a la incorporación de las pantallas LED retroiluminadas, la irradiancia ponderada espectralmente no alcanza los límites de exposición internacionales; incluso se ha demostrado que las emisiones son más bajas que la exposición natural a la luz solar, en un día nublado de invierno.(94)
En definitiva, existe una falta de evidencia clínica de alta calidad sobre el beneficio de las lentes en las gafas que bloquean la luz azul en la población general, para mejorar el rendimiento visual, la calidad del sueño, aliviar la fatiga ocular o conservar la salud macular.(7)
- Lente intraocular con filtro azul
Como bien sabemos, la cirugía ocular más comúnmente realizada a nivel mundial es, la cirugía de cataratas, con implantación de lentes intraoculares (LIO). Se ha planteado que las LIO, que filtran la luz azul, podrían presentar un efecto fotoprotector sobre la retina, y por lo tanto, sobre la salud pública, particularmente en el contexto de la creciente prevalencia mundial de DMAE.(24)
La aparición de cataratas, conlleva un acúmulo de cromóforos que absorben longitudes de onda cortas del espectro visible, y reduce la entrada de luz en más del 70%.(95,96) Existe una amplia gama de lentes intraoculares (LIO), y dos tipos de LIO, con filtro UV convencional (filtro de luz UV, UVF-IOL) y con filtro de luz azul (BLF-IOL), que a su vez se subdividen en LIO con filtro violeta (400-440 nm) y las que cubren todo el espectro (400-500 nm), con el objetivo de reducir el daño causado por las células pigmentadas de la retina expuestas a la luz UV y luz azul (la porción de luz azul comprende, la luz violeta, 400-440 nm, y la luz azul, 440-500 nm) y en consecuencia, el riesgo de DMAE.(95,96)
En una revisión sistemática Cochrane,(97) de 2018 con 51 ensayos clínicos controlados y aleatorizados, en 17 países, compararon el implante de LIO con filtro azul, frente a una LIO equivalente sin filtro de luz azul. Sin embargo, es de destacar que se observaron muchas limitaciones en los ensayos disponibles, con deficiencias importante en la validez interna de los mismos. El resultado primario de la revisión fue, con un nivel moderado de certeza, la ausencia de diferencia clínicamente significativas de agudeza visual a distancia mejor corregida, entre los dos tipos de LIO.(24,25,26,27,28,97) Además, no se observaron diferencias clínicamente significativas en la sensibilidad al contraste a corto plazo con las dos intervenciones.(24,25,26,27,28,97)
Las LIO con filtro de luz azul, reducen la exposición ocular a la radiación ultravioleta (longitudes de onda 200-400 nm) y a la luz visible de longitud de onda corta (violeta, 400-440 nm y azul, 440-500 nm). El fundamento de estas LIO, consiste en que presentan cromóforos, que absorben una proporción de las longitudes de onda que penetran en el ojo(24,97)
Los posibles y supuestos beneficios de las LIO con filtro azul, se podrían resumir en:(90)
- Alivian la fatiga ocular
- Mejoran la calidad del sueño
- Protegen frente a la fototoxicidad macular
En cuanto al tercer beneficio expuesto, se parte de la hipótesis de protección de la retina, por los datos publicados en varios trabajos, realizados en animales y cultivos celulares, además de estudios epidemiológicos, donde se demuestra que la exposición de alto nivel a la luz visible de longitud de onda corta puede inducir daño celular en la retina.(24,97,98,99,100)
Al extrapolar estos datos al ser humano, se ha sugerido que la luz azul puede contribuir al desarrollo y/o progresión de la DMAE(24,25) Sin embargo, y en contra de la hipótesis fototoxicidad-DMAE, el trabajo de Van Norren D y cols,(101) hace referencia a que el envejecimiento natural del cristalino puede absorber cantidades de luz UV y visible, secundario a la opacificación natural, y por lo tanto, disminuir el efecto de la luz sobre la retina.
De manera que una LIO ideal, debería teóricamente simular al cristalino de un adulto; las LIO que filtran la luz azul muestran curvas de transmisión similares a las del cristalino natural de una persona de 53 años, para ayudar a reducir el daño potencial de la luz azul que llega a la retina.
En efecto, se ha demostrado que las LIOs que filtran la luz azul, respecto a las LIO con filtro de luz UV ,reducen la incidencia de fotofobia y cianopsia (un tipo de cromatopsia, donde existe una alteración en la percepción de los colores en la que todos los objetos visibles tienen aparentemente un tono azulado), en el posoperatorio inmediato.(103,104) Curiosamente, Nakano y cols, concluyeron en otro estudio que las LIO con filtro con filtro violeta reducían la cianopsia con mejores resultados respecto a las LIO con filtro de luz azul total (15 casos vs 8 casos), una semana después de la cirugía.(103)
Mainster y Turner, afirmaron que la implantación de LIO con filtro azul son prácticas médicas basadas en hipótesis, en lugar de prácticas basadas en la evidencia.(24,106)
Los ensayos clínicos integrados por la revisión Cochrane de 2018, destacan por la escasa evidencia de alta calidad y la corta duración de seguimiento (menos de 3 meses la mayoría) de los trabajos. De manera que en esta revisión queda manifiesto, basándose en la mejor evidencia actual disponible, que no está claro si las LIO con filtro de luz azul evitan la toxicidad macular y/o modifican los riesgos asociados con el desarrollo y la progresión de la DMAE.(24,25,26,27,28,97) Actualmente la asociación de las LIO que filtran la luz azul con la fotoprotección macular o la afectación del curso clínico de la DMAE, siguen siendo inciertos.(24,97)
Además, recientemente, Achiron y cols, observaron que el uso de LIO con filtro de luz azul, no presentaba ventajas sobre las LIO con filtro de luz UV, ni en la incidencia, ni progresión ni en los resultados clínicos (agudeza visual mejor corregida, grosor foveal, intervalo de tratamiento y número de inyecciones) relacionados con la gravedad de la DMAE neovascular.(105) Este estudio se basó en una gran cohorte de pacientes que se sometieron a cirugía de cataratas, en el que se usaron por una lado LIO con filtro de luz azul (5.425 ojos ) y por otro LIO con filtro de luz UV (5.972 ojos).
Para resumir en cuanto a la evidencia existente actual respecto a este tema tan controvertido, mencionar los siguientes resultados:
- Un meta-análisis demostró un rendimiento visual similar entre los 2 tipos de LIO. Sin embargo, la visión del color se redujo significativamente en condiciones mesópicas con las LIO bloqueadoras de luz azul, sin encontrarse diferencias en la agudeza visual mejor corregida a distancia, sensibilidad al contraste, visión general del color, en condiciones fotópicas.(102)
- Dos revisiones sistemáticas, concluyeron que no existe un consenso sobre cual de los dos tipos de LIO, ofrece una mayor fotoprotección.(97,107)
- Tres trabajos, concluyeron que no hay pruebas de que una de las dos LIO (con y sin filtro de luz azul) sea mejor que la otra, en lo que se refiere a ritmo circadiano normal.(96,108,109)
- En otro meta-análisis, se demostró que la implantación de LIO con filtro de luz UV, reducía significativamente la puntuación del PSQI (Pittsburgh Sleep Quality Index), en comparación con la LIO con filtro de luz azul, hasta 8 semanas después de la cirugía de cataratas, sin observar diferencias 7-12 meses después de la cirugía. El PSQI, distingue a los que duermen bien de los que duermen mal, calificando 7 componentes diferentes del sueño durante el último mes, combinándose para crear una puntuación general para la calidad del sueño. Tras la cirugía, la transmisión de la luz aumentaría en un 250% en pacientes con cataratas con implante de LIO-bloqueadoras de luz azul y en un 300% en pacientes con LIO-bloqueadoras de luz UV convencional, de manera que es la transmisión de luz adicional, la responsable del beneficio en la calidad del sueño, que es adaptada por el sistema circadiano y vuelve a la normalidad tras un período de 7 meses a 10 meses. En definitiva, en este meta-análisis se concluyó que no existía suficiente evidencia para recomendar el uso de LIO con filtro azul, ya que la calidad del sueño y la latencia del mismo mejoran tras la cirugía de catarata, independientemente del tipo de LIO implantado; Sin embargo, también se concluyó de que el implante de una LIO con filtro azul no tiene un impacto negativo en el ciclo sueño-vigilia.(101)
- Revisiones sistemáticas recientes, han demostrado que LIO con filtro de luz azul y LIO con filtro de luz UV, no difieren en términos de AV mejor corregida, sensibilidad al contraste, discriminación de color, estado de alerta diurno, tiempo de reacción o satisfacción del paciente.(111,107,112)
- En el trabajo de Alexander I y cols, se evaluó la calidad del sueño en 961 pacientes, tras cirugía de cataratas, mediante el cuestionario PSQI, observando que la calidad general y latencia del sueño mejoran tras la extracción de la catarata, independientemente de la LIO implantada. No hubo diferencias significativas en las puntuaciones generales del sueño entre las dos LIO: LIO-bloqueadoras UV y LIO-bloqueadoras de luz azul; además, la reducción de la transmisión de la luz azul con una LIO- bloqueadoras de luz azul, al compararla con la LIO- bloqueadoras UV, no resultó ser clínicamente significativa. De manera que se demuestra en este trabajo, que implantar una LIO-bloqueadoras de luz azul no tiene ningún impacto en el ciclo de sueño-vigilia.
Se ha llevado a cabo una auditoría clínica(114) para determinar la incidencia de glistening en la LIO Alcon Acrysoft, con y sin cromóforo amarillo, clasificándolos mediante los criterios de Werner et al,(115) añadiendo un nivel de densidad de Grado 4. Para ello, se analizan 4 modelos de LIO (MA de 3 piezas, 74 SA60AT, 57 SN60AT, 153 SN60WF). Los resultados obtenidos son los siguientes:(114)
- 35% de LIO transparentes y un 66% de LIO amarillas, mostraron glistening (total de LIO auditadas 284).
- Grado 2 o más, 2% de LIO transparentes y un 35% de LIO amarillas.
;
En esta auditoría se sugieró que las LIO con cromóforos, presentaban más probabilidades de mostrar y una mayor densidad de glistening que las LIO sin cromóforos del mismo material. De manera que los resultados sugieren que el cromóforo está fuertemente asociado con la formación de glistening.(114)
Se ha publicado el caso de una maestra de 58 años, sometida 10 años antes a un intercambio de lentes refractivas con implante de LIO multifocal con cromóforos que bloquean la luz azul con glistening incapacitantes, que dificultaba la conducción nocturna, le impedía ver las expresiones faciales de sus alumnos bajo luces fluorescentes y le afectaba su capacidad para trabajar.(116)
Se sometió a la paciente a capsulotomías posteriores, sin obtener beneficio, se trató con lubricantes, por su sequedad ocular y se corrigió el astigmatismo con gafas, pasando de una MAVSC de 6/12 y MAVCC 6/12 a una MAVCC 6/7.5, pero persistía el deslumbramiento. Por las capsulotomías realizadas, el cirujano desestimó el intercambio de LIO, porque los riesgos superaban los beneficios.(116)
En definitiva, los cirujanos/as refractivos deben reflexionar sobre la esperanza de vida de los pacientes sometidos al implante de LIO con cromóforos. En caso de glistening importantes, se debe considerar el intercambio de LIO antes de realizar la capsulotomía posterior.(116)
Actualmente no existe la suficiente evidencia (basándonos siempre en la mejor evidencia disponible), en que el implante de LIO con filtro de luz azul sea mejor, con respecto al implante de LIO equivalente sin filtro de luz azul.(24)
Conclusiones
- La luz ambiental que llega a la retina está compuesta por infrarrojos (700-1200 nm), espectro visible (400-700 nm) y en personas jóvenes, luz UV-B (280-315 nm).(5,18,19,20,21,22,23)
- El riesgo de daño retiniano secundario a la luz azul emitida por dispositivos digitales y fuentes de luz doméstica es mínimo, incluso en condiciones de visualizaciones extremas a largo plazo.(24,28)
- Las capas externas de la retina central son las más sensibles al daño fotoquímico, siendo las anomalías más comunes, la rotura de las células del EPR y el daño del segmento externo de los fotorreceptores. Sin embargo, los efectos fotoquímicos y fototérmicos, no contribuyen de manera significativa a la retinopatía UV.(2,35,36,37,38,39,40)
- La incidencia de maculopatía fototóxica es incierta, pero se estima en torno al 0.14-15 % de los casos, se produce en el contexto de soldaduras.(44)
- Las personas con mayor riesgo de sufrir los efectos fototóxicos de la radiación UV son: trabajadores con exposición a la luz solar y UV alta (militares, marineros, soldadores…), afáquicos (los más susceptibles, al carecer de capacidad para aboserber la luz UV peligrosa) y pseudofáquicos(40,78,79,80,81,82) Para estos grupos de riesgo, Adrian, Fishman y Ham, sugieren el uso de gafas con filtros UV (300-400 nm), especialmente en los afáquicos.(40,81,82)
- Se ha demostrado que una exposición crónica a la luz solar, parece aumentar el riesgo de DMAE; con un riesgo adicional (determinado por un análisis de subgrupos) en poblaciones con una renta per cápita más baja.(74)
- Se desconoce si la suplementación con antioxidantes, tras una exposición aguda, podría mejorar la recuperación visual.(2)
- Los beneficios de los corticoides se limitan a una ventana precoz tras la exposición a la luz, siempre teniendo cuenta el balance riesgo-beneficio.(84,85,86)
- Actualmente existe una falta de evidencia clínica de alta calidad para recomendar el empleo de filtros de luz azul en las gafas, en la población general, para mejorar el rendimiento visual, la calidad del sueño, aliviar la fatiga ocular o conservar la salud macular. (7)
- Actualmente el implante de LIO con filtro de luz azul, carece de evidencia clara, para ser recomendadas, respecto al implante de LIO sin filtro de luz azul, como fotoprotectoras de la mácula y/o modificar los riesgos asociados con el desarrollo y progresión de la DMAE. (24,97)
Bibliografía
- Bullock JD. The blindness of Saint Paul. Ophthalmology. 1978;85:1044e53
- Galilei G: Istoria e Dimostrazioni intorno alle Macchie Solari. Giacomo Mascardi, Roma, 1613.
- Rosen E. Solar retinitis. Br J Ophthalmol. 1948;32:23e35
- Tower P. Solar retinitis due to exposure during eclipse. Ann West Med Surg. 1948;2:217e21
- Begaj T, Schaal S. Sunlight and ultraviolet radiationdpertinent retinal implications and current management. Surv Ophthalmol. 2018; 63(2):174-192
- Rothkoff L, Kushelevsky A, Blumenthal M. Solar retinopathy: visual prognosis in 20 cases. Isr J Med Sci. 1978;14:238e43
- Lawrenson JG, Hull CC, Downie LE. The effect of blue-light blocking spectacle lenses on visual performance, macular health and the sleep-wake cycle:a systematic review of the literature. Ophthalmic Physiol Opt. 2017; 37(6):644-654
- Noell WK, Walker VS, Kang BS & Berman S. Retinal damage by light in rats. Invest Ophthalmol 1966; 5: 450–473.
- Ham WT, Mueller HA, Ruffolo JJ Jr, Guerry D & Guerry RK. Action spectrum for retinal injury from near-ultraviolet radiation in the aphakic monkey. Am J Ophthalmol 1982; 93: 299–306.
- Sparrow JR, Miller AS & Zhou J. Blue light-absorbing intraocular lens and retinal pigment epithelium protection in vitro. J Cataract Refract Surg 2004; 30: 873–878.
- Davies S, Elliott MH, Floor E et al. Photocytotoxicity of lipofuscin in human retinal pigment epithelial cells. Free Radic Biol Med 2001; 31: 256–265.
- Haigh JD. The sun and the earth’s climate. Living Rev Solar Phys. 2007;4:2
- Cuthbertson FM, Peirson SN, Wulff K, Foster RG & Downes SM. Blue light-filtering intraocular lenses: review of potential benefits and side effects. J Cataract Refract Surg 2009; 35: 1281–1297.
- Boulton M, Rozanowska M & Rozanowski B. Retinal photo- 240. damage. J Photochem Photobiol B. 2001; 64: 144–61.
- Ayaki M, Hattori A, Maruyama Y et al. Protective effect of blue-light shield eyewear for adults against light pollution from self-luminous devices used at night. Chronobiol Int 2016; 33: 134–139.
- Young RW. Solar radiation and age-related macular degeneration. Surv Ophthalmol. 1988;32:252e69
- Serm Janjai AW. Standard Operating Procedures for Spectral Instruments Measuring Spectral Solar Ultraviolet Irradiance. Geneva, Switzerland, World Meteorological Organization (WMO); 2014. GAW Report No. 212.
- Coddington O, Lean JL, Pilewskie P, et al. A solar irradiance climate data record. Bull Am Meterol Soc. 2016;97:1265e82
- Arnault E, Barrau C, Nanteau C, et al. Phototoxic action spectrum on a retinal pigment epithelium model of age- related macular degeneration exposed to sunlight normalized conditions. PLoS One. 2013;8:e71398
- Bowmaker JK,Dartnall HJ. Visual pigment so frods and cones in a human retina. J Physiol. 1980;298:501e11
- Boettner EA, Wolter JR. Transmission of the ocular media. Invest Ophthalmol Vis Sci. 1962;1:776e83
- Dillon J, Zheng L, Merriam JC, Gaillard ER. Transmission spectra of light to the mammalian retina. Photochem Photobiol. 2000;71:225e9
- Sliney DH. How light reaches the eye and its components. Int J Toxicol. 2002;21:501e9
- Downie LE, Wormald R, Evans J et al. Analysis of a Systematic Review About Blue Light–Filtering Intraocular Lenses for Retinal Protection: Understanding the Limitations of the Evidence. JAMA Ophthalmol. 2019; 137(6):694-697
- Toc Toc Communications. #bluelightexposed. http://www.bluelightexposed.com/. Accessed May 28, 2018.
- Smith AK, Conger JR, Hedayati B et al. The effect of a Sccreen Protector on Blue Light Intensity Emitted from Different Hand-held Devices. Middle EastAfr J Ophthalmol. 2020;27(3):177-181
- Moon J, Yun J, Yoon YD et al. Blue light effect on retinal pigment epithelial cells by display devices. Integr Biol (Camb) 2017; 9: 436–443.
- O’Hagan JB, Khazova M, Price LL. Low-energy light bulbs, computers, tablets and the blue light hazard. Eye (Lond). 2016;30(2):230–233. doi:10.1038/eye.2015.261 [PubMed: 26768920]
- Dillon J, Zheng L, Merriam JC, Gaillard ER. The optical properties of the anterior segment of the eye: implications for cortical cataract. Exp Eye Res. 1999;68:785e95
- Kessel L, Lundeman JH, Herbst K, et al. Age-related changes in the transmission properties of the human lens and their relevance to circadian entrainment. J Cataract Refract Surg. 2010;36:308e12
- Das T, Nirankari MS, Chaddah MR. Solar chorioretinal burn. Am J Ophthalmol. 1956;41:1048e53
- Birch-Hirshlfeld B. Zum kapitel der sonnenblendung des Auges. Zeitschrift fur Augenheilkunde. 1912;28:324e47, 444e449 and 509e530.
- Cordes F. A type of foveomacular retinitis observed in the US Navy. Am J Ophthalmol. 1944;27:803e16
- Wergeland FL Jr, Brenner EH. Solar retinopathy and foveomacular retinitis. Ann Ophthalmol. 1975;7:495e8, 501e493.
- Glickman RD. Phototoxicity to the retina: mechanisms of damage. Int J Toxicol. 2002;21:473e90
- Glickman RD. Ultraviolet phototoxicity to the retina. Eye Contact Lens. 2011;37:196e205
- Wu J, Seregard S, Algvere PV. Photochemical damage of the retina. Surv Ophthalmol. 2006;51:461e81
- Pocock GM, Oliver JW, Specht CS, et al. High-resolution in vivo imaging of regimes of laser damage to the primate retina. J Ophthalmol. 2014;516854:2014
- Yin H, Xu L, Porter NA. Free radical lipid peroxidation: mechanisms and analysis. Chem Rev. 2011; 111(10): 5944-72
- Ham WT Jr. Ocular hazards of light sources: review of current knowledge. J Occup Med. 1983;25:101e3
- Verhoeff FH, Bell L. The pathological effects of radiant energy on the eye. Proc Am Acad Arts Sci. 1916;51:627e818
- Milsom PK, Till SJ, Rowlands G. The effect of ocular aberrations on retinal laser damage thresholds in the human eye. Health Phys. 2006; 91(1):20-8
- Lombardi DA, Pannala R, Sorock GS, et al. Welding related occupational eye injuries: a narrative analysis. Inj Prev. 2005;11:174e9
- Vukicevic M, Heriot W. Phototoxic maculopathy associated with arc welding: clinical findings and associated functional vision impairment. Clin Exp Ophthalmol. 2008;36:695e7
- Magnavita N. Photoretinitis: an underestimated occupational injury? Occup Med (Lond). 2002;52:223e5
- Maier R, Heilig P, Winker R, et al. Welder’s maculopathy? Int Arch Occup Environ Health. 2005;78:681e5
- Yeh LK, Yang CS, Lee FL, et al. Solar retinopathy: a case report. Zhonghua Yi Xue Za Zhi (Taipei). 1999;62:886e90
- De Niro JE, Randhawa S, McDonald HR. Retinal vascular tortuosity in DiGeorge syndrome complicated by solar retinopathy. Retin Cases Brief Rep. 2013;7:343e6
- Galainena ML. Solar retinopathy. Ann Ophthalmol. 1976;8:304e6
- Devadason DS, Mahmood S, Stanga PE, Bishop PN. Solar retinopathy in a patient with bipolar affective disorder. Br J Ophthalmol. 2006;90:247
- Horowitz MJ. Flashbacks: recurrent intrusive images after the use of LSD. Am J Psychiatry. 1969;126:565e9
- Chawla R, Mittal K, Venkatesh P, Sharma YR. Solar retinopathy following cannabis consumption. Clin Exp Optom. 2017;100:92e3
- Gilkes MJ. Solar retinopathy. Br Med J. 1968;3:678e9
- Gupta RB, Mehra SK. Solar retinitis. J Indian Med Assoc. 1964;43:268e70
- Irvine WD, Smiddy WE, Nicholson DH. Corneal and iris burns with the laser indirect ophthalmoscope. Am J Ophthalmol. 1990;110:311e3
- Rubinfeld RS, Pilkerton AR Jr, Zimmerman LE. A corneal complication of indirect ophthalmic laser delivery systems. Am J Ophthalmol. 1990;110:206e8
- Cai YS, Xu D, Mo X. Clinical, pathological and photochemical studies of laser injury of the retina. Health Phys. 1989;56:643e6
- Barkana Y, Belkin M. Laser eye injuries. Surv Ophthalmol. 2000;44:459e78
- Alsulaiman SM, Alrushood AA, Almasaud J, et al. High- power handheld blue laser-induced maculopathy: the results of the King Khaled Eye Specialist Hospital Collaborative Retina Study Group. 2014;121:566e72
- Kerr LM, Little HL. Foveomacular retinitis. Arch Ophthalmol. 1966;76:498e504
- Rocha Cabrera P, Cordoves Dorta L, Gonzalez Hernandez M. Bilateral solar retinopathy. Autofluorescence and optical coherence tomography. Arch Soc Esp Oftalmol. 2016;91:391e6
- Dhir SP, Gupta A, Jain IS. Eclipse retinopathy. Br J Ophthalmol. 1981;65:42e5
- Leys A, Swinnen T, Hannon L, Van Wing F. Solar retinopathy and foveal cysts. Bull Soc Belge Ophtalmol. 1978;182:74e81
- Tarr KH, Clemett RS. Late features of solar retinopathy. Trans Ophthalmol Soc N Z. 1983;35:26e8
- Cho HJ, Yoo ES, Kim CG, Kim JW. Comparison of spectral-domain and time-domain optical coherence tomography in solar retinopathy. Korean J Ophthalmol. 2011;25:278e81
- De Carlo TE, Romano A, Waheed NK, Duker JS. A review of optical coherence tomography angiography (OCTA). Int J Retina Vitreous. 2015;1:5
- Arda H, Oner A, Mutlu S, et al. Multifocal electroretinogram for assessing sun damage following the solar eclipse of 29 March 2006: multifocal electroretinography in solar maculopathy. Doc Ophthalmol. 2007;114:159e62
- Birdsong O, Ling J, El-Annan J. Solar retinopathy. Ophthalmology. 2016;123:570
- Sparrow JR, Boulton M. RPE lipofuscin and its role in retinal pathobiology. Exp Eye Res. 2005;80:595e606
- Brue C, Mariotti C, De Franco E, et al. Solar retinopathy: a multimodal analysis. Case Rep Ophthalmol Med. 2013;2013:906920
- Shukla D. Optical coherence tomography and autofluorescence findings in chronic phototoxic maculopathy secondary to snow-reflected solar radiation. Indian J Ophthalmol. 2015;63:455e7
- Plestina-Borjan I, Klinger-Lasic M. Long-term exposure to solar ultraviolet radiation as a risk factor for age-related macular degeneration. Coll Antropol. 2007;31(Suppl 1):33e8
- Vojnikovic B, Njiric S, Coklo M, Spanjol J. Ultraviolet sun radiation and incidence of age-related macular degeneration on Croatian Island Rab. Coll Antropol. 2007;31(Suppl 1):43e4
- Sui GY, Liu GC, Liu GY, et al. Is sunlight exposure a risk factor for age-related macular degeneration? A systematic review and meta-analysis. Br J Ophthalmol. 2013;97:389e94
- Liou JC, Teng MC, Tsai YS, et al. UV-blocking spectacle lens protects against UV-induced decline of visual performance. Mol Vis. 2015;21:846e56
- Citek K. Anti-reflective coatings reflect ultraviolet radiation. 2008;79:143e8
- Kemp CM, Weale RA. Over-exposed film as a protector against solar retinopathies. 1982;1:1348e9
- Chou BR. Retinal protection from solar photic injury. Am J Optom Physiol Opt. 1981;58:270e80
- Hunyor AB. Solar retinopathy: its significance for the ageing eye and the younger pseudophakic patient. Aust N Z J Ophthalmol. 1987;15:371e5
- Roh S, Weiter JJ. Light damage to the eye. J Fla Med Assoc. 1994;81:248e51
- Adrian W, Everson RW, Schmidt I. Protection against photic damage in retinitis pigmentosa. Adv Exp Med Biol. 1977;77:233e47
- Fishman GA. Ocular phototoxicity: guidelines for selecting sunglasses. Surv Ophthalmol. 1986;31:119e24
- Li ZY, Tso MOM, Wang HM. Amelioration of photic injury in rat retina by ascorbic acid: A histopathologic study. Invest Ophthalmol Vis Sci. 1985;26:1589e98
- Stoyanovsky DA, Goldman R, Darrow RM. Endogenous ascorbate regenerates vitamin E in the retina directly and in combination with exogenous dihydrolipoic acid. Curr Eye Res. 1995;14:181e9
- Koc RK, Akdemir H, Karakucuk EI, et al. Effect of methylprednisolone, tirilazad mesylate and vitamin E on lipid peroxidation after experimental spinal cord injury. Spinal Cord. 1999;37:29e32
- Schatz H, Mendelblatt F. Solar retinopathy from sun-gazing under the influence of LSD. Br J Ophthalmol. 1973;57:270e3
- Weber P, Kurlemann G, Lunecke C, Tondera A. [Solar retinopathy. Rare cause of acute loss of vision]. Dtsch Med Wochenschr. 1996;121:793e6
- Lin JB, Gerratt BW, Bassi CJ & Apte RS. Short-wavelength light-blocking eyeglasses attenuate symptoms of eye fatigue. Invest Ophthalmol Vis Sci 2017; 58: 442–447.
- Benedetto S, Drai-Zerbib V, Pedrotti M, Tissier G & Baccino T. E-readers and visual fatigue. PLoS ONE 2013; 8: e83676.
- Rosenfield M. Computer vision syndrome: a review of ocular causes and potential treatments. Ophthalmic Physiol Opt 2011; 31: 502–515.
- Gowrisankaran S & Sheedy JE. Computer vision syndrome: a review. Work 2015; 52: 303–314.
- Burkhart K & Phelps JR. Amber lenses to block blue light and improve sleep: a randomized trial. Chronobiol Int 2009; 26: 1602–1612.
- Leung TW, Li RW & Kee CS. Blue-light filtering spectacle lenses: optical and clinical performances. PLoS ONE 2017; 12: e0169114.
- O’Hagan JB, Khazova M & Price LL. Low-energy light bulbs, computers, tablets and the blue light hazard. Eye (Lond) 2016; 30: 230–233.
- Downie LE, Busija L, Keller PR. Blue-light filtering intraocular lenses (IOLs) for protecting macular health. Cochrane Database Syst Rev. 2018;5:CD011977. [PubMed: 29786830]
- Noell WK, Walker VS, Kang BS, Berman S. Retinal damage by light in rats. Invest Ophthalmol. 1966;5(5):450–473. [PubMed: 5929286]
- Davies S, Elliott MH, Floor E, et al. Photocytotoxicity of lipofuscin in human retinal pigment epithelial cells. Free Radic Biol Med. 2001;31(2):256–265. doi:10.1016/S0891-5849(01)00582-2 [PubMed: 11440838]
- Kuse Y, Ogawa K, Tsuruma K, Shimazawa M, Hara H. Damage of photoreceptor-derived cells in culture induced by light emitting diode-derived blue light. Sci Rep. 2014;4:5223. doi:10.1038/ srep05223 [PubMed: 24909301]
- Mainster MA, Turner PL. Blue-blocking IOLs vs. short-wavelength visible light: hypothesis-based vs. evidence-based medical practice. Ophthalmology. 2011;118(1):1–2. doi:10.1016/j.ophtha. 2010.11.016 [PubMed: 21199710]
- Simunovic MP. On seeing yellow: the case for, and against, short- wavelength light-absorbing intraocular lenses. Arch Ophthalmol. 2012;130:919–26.
- Alexander I, Cuthbertson FM, Ratnarajan G, Safa R, Mellington FE, Foster RG, et al. Impact of cataract surgery on sleep in patients receiving either ultraviolet-blocking or blue-filtering intraocular lens implants. Investig Ophthalmol Vis Sci. 2014;55:4999–5004.
- Zhu XF, Zou HD, Yu YF, Sun Q, Zhao NQ. Comparison of blue light-filtering IOLs and UV light-filtering IOLs for cataract surgery: a meta-analysis. PLoS One. 2012;7(3):e33013.
- Nakano S, Miyata A, Kizawa J et al. Blue light-filtering and violet light-filtering hydrophobic acrylic foldable intraocular lenses: Intraindividual comparison. J Cataract Refract Surg. 2019; 45(10): 1393-1397.
- Li X, Kelly D, Nolan JM, Dennison JL, Beatty S. The evidence informing the surgeon’s selection of intraocular lens on the basis of light transmittance properties. Eye. 2017;31:258–72.
- Achiron A, Elbaz U, Hecht I et al. The Effect of Blue-Light Filtering Intraocular Lenses on the Development and Progression of Neovascular Age-Related Macular Degeneration. Ophthalmology. 2021; 128 (3):410-416
- Erichsen JH, Brøndsted AE, Kessel L. Effect of cataract surgery on regulation of circadian rhythms. J Cataract Refractive Surg. 2015;41:1997–2009.
- Zheng L, Wu XH, Lin HT. The effect of cataract surgery on sleep quality: a systematic review and Meta-analysis. Int J Ophthalmol. 2017;10:1734–41.
- Lee T-M, Loh E-W, Kuo T-C et al. Effects of ultraviolet and blue-light filtering on sleep: a meta-analysis of controlled trials and studies on cataract patients. Eye (Lond). 2020;
- Cuthbertson FM, Peirson SN, Wulff K, Foster RG, Downes SM. Blue light-filtering intraocular lenses: review of potential benefits and side effects. J Cataract Refract Surg. 2009;35: 1281–97.
- Augustin AJ. Blue light-filtering IOLs-currently available data. Klin Monbl Augenheilkd. 2010;227:617–23.
- Van Norren D, van de Kraats J (2007) Spectral transmission of intraocular lenses expressed as a virtual age. Br J Ophthalmol 91: 1374–1375.
- Yap M (1984) The effect of a yellow filter on contrast sensitivity. Ophthalmic Physiol Opt 4: 227–232.
- Yuan Z, Reinach P, Yuan J (2004) Contrast sensitivity and color vision with a yellow intraocular lens. Am J Ophthalmol 138: 138–140.
- House P, Rahman AA, Richards J et al. Long-term clinical audit of glistenings in Alcon Acrysof intraocular lenses with and without yellow chromophore.
- Werner L. Glistenings and surface light scattering in intraocular lenses. J Cataract Refract Surg. 2010;36(8):1398-420.
- Richards J, House P, McAllister IL et al. Disabling glistenings in multifocal yellow chromophore intraocular lenses. Clin Exp Ophthalmol. 2020; 48(3):408-409
Autores

Sidi Mohamed Hamida Abdelkader. MD.
– Complejo Hospitalario Universitario Torrecárdenas (Almería)

Carlos Rocha de Lossada. MD, FEBO.
– Departamento de Oftalmología (Qvision), Vithas Almería
– Hospital Universitario Virgen de las Nieves (Granada).
– Ceuta Medical Center (Ceuta).
