
La distrofia endotelial de Fuchs y la queratopatía bullosa pseudofáquica: de la queratoplastia a la Rho-Kinasa
INTRODUCCIÓN
La Distrofia Endotelial de Fuchs (FED) es una entidad bilateral, esporádica o de herencia autosómica dominante, caracterizada por una pérdida progresiva de células endoteliales. La Queratopatía Bullosa Pseudofáquica (PBK) surge de una pérdida de células endoteliales acelerada tras la cirugía de cataratas. Ambas suponen cada vez indicaciones más frecuentes de queratoplastia, tanto lamelar como penetrante, en nuestro país y llegando a ser la indicaciones más frecuentes en EEUU.(1)
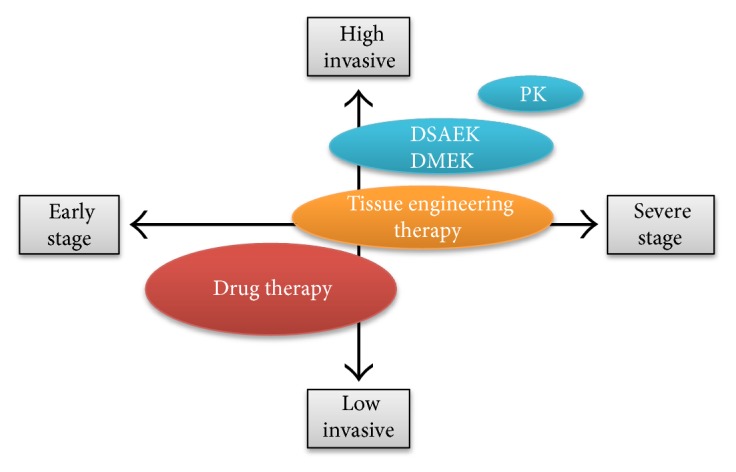
Durante más de 100 años, la queratoplastia penetrante ha permanecido como la única técnica quirúrgica definitiva para las enfermedades corneales endoteliales. En las últimas dos décadas, ésta ha sido reemplazada por trasplantes lamelares que únicamente reemplazan las porciones afectadas de la córnea. La DSAEK (Descemet Stripping Automated Endothelial Keratoplasty) se realiza introduciendo un injerto donante de la membrana de Descemet, endotelio y una porción del estroma posterior a través de una incisión corneal o esclerocorneal en el receptor. Actualmente es la técnica que más se realiza, logrando ocupar poco más del 40% de todos los trasplantes corneales realizados en EE.UU.(2). Posteriormente, la DMEK (Descemet Membrane Endothelial Keratoplasty), técnica que se basa en el trasplante de la membrana de Descemet y endotelio, logró demostrar mejores resultados visuales y menor tasa de complicaciones, a expensas de complicaciones intraquirúrgicas más frecuentes debido a la curva de aprendizaje que conlleva, principalmente el re-bubbling y el re-grafting.(3, 4).
Por ello, se planteado incluso realizar una DSAEK mediante un injerto más fino (<100 micras), denominada Ultra-Thin DSAEK (UT-DSAEK). Sin embargo, el ensayo DETECT(5) concluyó que los resultados en la agudeza visual final eran mayores en pacientes intervenidos de DMEK frente a esta técnica.
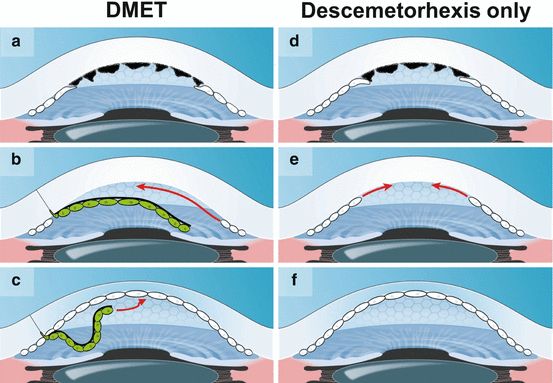
Otra técnica desarrollada intentando evitar la dificultar quirúrgica de la DMEK, es la Descemet Membrane Endothelial Transfer (DMET), es decir, la implantación de un injerto endotelial y de la membrana de Descemet libre y flotante en la cámara anterior, únicamente adherida a la córnea receptora a nivel de la incisión corneal por el cuál se introduce el injerto. Esta idea surgió tras observar una transparencia corneal en pacientes que sufrieron un desprendimiento parcial del injerto tras DSAEK o DMEK (6, 7). Birbal et al. publicaron una serie de 16 casos dónde sólo aquellos con FED mostraron una reducción del edema corneal transitorio con un empeoramiento posterior tras 6 meses, mientras que aquellos con PBK no mejoraron en ningún momento del postoperatorio(8). Se postula que esto es debido a que existe una depleción significante de células endoteliales en la PBK y, por lo contrario, el endotelio periférico está relativamente conservado en la FED. El mecanismo por el cual la DMET puede lograr la transparencia corneal es mediante la estimulación de la respuesta migratoria endotelial de células receptoras aún funcionantes(8). Sin embargo, la capacidad regeneradora en pacientes con FED puede ser insuficiente para garantizar una transparencia corneal más duradera, ya que sólo se ha comprobado resultados optimistas en un tiempo limitado (6 meses). Esta teoría revolucionaría el término FED, puesto que el término distrofia implica la disfunción de la célula endotelial. Estos resultados apoyan a que todavía se precisan estudios para comprobar su eficacia.
Similar a la técnica anterior, algunos autores mencionan pacientes que han logrado transparencia corneal simplemente realizando la descematorhexis del receptor, sin introducción de injerto donante (9), denominándose Descemet Without Endothelial Keratoplasty (DWEK) ó Descemet Stripping Only (DSO) . Esto podría ser justificado en pacientes con descematrohexis pequeñas y centrales, con un endotelio periférico sano. Davies describió traspariencia corneal en 14 de los 17 sujetos incluidos en su estudio(10). Sin embargo, numerosos estudios han publicado el fracaso de esta técnica en alcanzar la transparencia corneal en pacientes con FED(11).
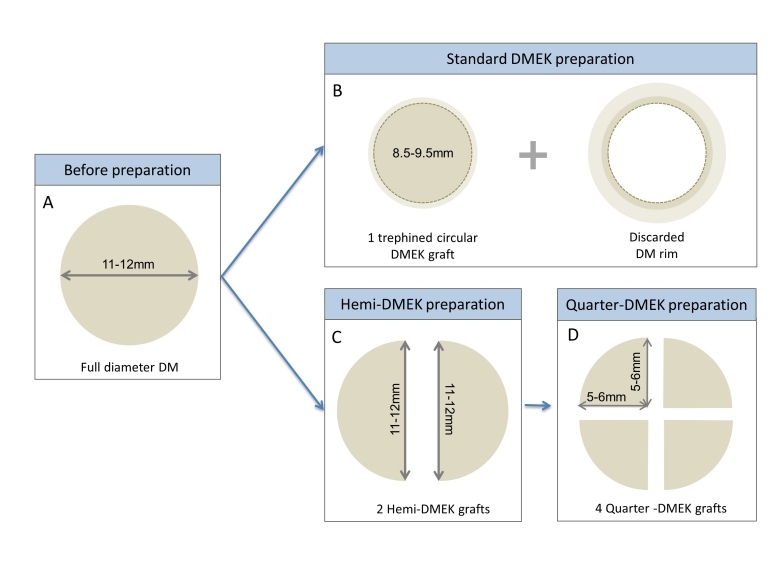
En un intento de sumar las ventajas de la DMET, aumentando la migración de células endoteliales funcionantes, y de la DMEK, que ha demostrado obtener la mejor AV postoperatoria entre las técnicas mencionadas, surge el concepto de Hemi y Quarter DMEK. Esto es, trasplantar la mitad o un cuarto del tamaño de un injerto normal, que normalmente mide unos 8mm, previa realización de una descematorhexis tradicional de unos 7-8mm.(12,13) Los resultados de Hemi-DMEK son favorables, a la hora de comparar la AV final comparándolo con una DMEK normal, a pesar de un recuento endotelial disminuido a partir del sexto mes postoperatorio que se mantiene estable y en niveles aceptables posteriormente(12). Aún se precisa estudios con más seguimiento de Quarter DMEK, aunque se ha comprobado que alcanza una AV igual que tras DMEK. Sin embargo, el recuento endotelial es demasiado bajo y se precisa de un seguimiento mayor para garantizar que los resultados funcionales permanecen estables(13). El beneficio de estas dos técnicas es el de poder aumentar el pool de tejidos endoteliales donantes, aumentando potencialmente la disponibilidad para realizar un mayor número de queratoplastias.
En resumen, el trasplante corneal endotelial representa el gold standard, , sustituyendo a la queratoplastia penetrante, para el tratamiento de la disfunción endotelial(14).
Introducción a los inhibidores ROCK
En 1998, Alan Hall aclaró la relación entre la vía de Rho Kinasa y las funciones del citoesqueleto de actina. Demostró que la vía de la quinasa Rho era un importante regulador del citoesqueleto de actina y que tenía varias reacciones dentro de esta vía(15,16).
La ruta Rho / ROCK participa en la regulación del citoesqueleto, la migración celular, la apoptosis celular y la proliferación celular. En términos de proliferación celular, las GTPasas Rho desempeñan un papel fundamental en la progresión del ciclo celular(17). El componente ROCK, inicialmente aislado como una proteína unida a GTP, tiene dos isoformas, ROCK I y ROCK II, que comparten una similitud del 60% en la secuencia de aminoácidos y una similitud del 90% en el dominio quinasa (18). Las Rho-quinasas participan en la regulación independiente de calcio en la contracción del músculo liso. Además, se han relacionado con las fuerzas contráctiles de la actomiosina, la adhesión celular, la rigidez celular, la reorganización de la matriz extracelular, la morfología celular y la apoptosis(17,18,19,20). Parece ser que el efecto de la señalización de la vía Rho / ROCK es totalmente dependiente del tipo de célula(17).
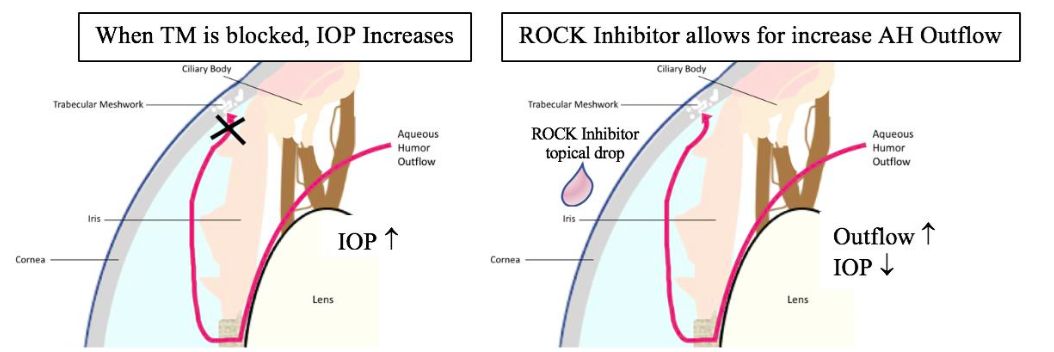
Estos factores han demostrado ser determinantes de la salida del Humor acuoso (HA) a través de la vía trabecular. Por lo tanto, a través de la evidencia fisiológica, se sugiere que hay una relación directa entre la funcionalidad de la quinasa Rho y el flujo de salida del humor acuoso (HA) que pasa a través de la vía trabecular.
Los inhibidores ROCK han demostrado que alteran la forma celular en la malla trabecular, lo que permite un mejor flujo de salida de HA y la disminución de la PIO(16).
En 2014, Ripasudil, un inhibidor ROCK, obtuvo la aprobación en Japón para ser utilizado específicamente para el tratamiento de la hipertensión ocular y el glaucoma. Recientemente, el 18 de diciembre de 2017, Rhopressa, un medicamento inhibidor de la Kinasa Rho (Netarsudil), obtuvo la aprobación de la Administración de Alimentos y Medicamentos (FDA), siendo el primero de su tipo en lograrlo hacerlo en los Estados Unidos de América(19).
La señalización de ROCK está involucrada en una variedad de enfermedades, que incluyen patología vascular, cáncer, asma, resistencia a la insulina, insuficiencia renal, osteoporosis, enfermedad degenerativa neuronal y glaucoma(18). Por lo tanto, en cuanto a las aplicaciones clínicas futuras, se espera que los inhibidores de ROCK sean útiles para una amplia gama de problemas como las enfermedades cardiovasculares, pulmonares y cancerosas(17,18). Por ejemplo, el uso clínico de fasudil, uno de los inhibidores ROCK, ya ha sido aprobado en Japón y China para la prevención y el tratamiento del vasoespasmo cerebral, y hasta la fecha, se ha utilizado en más de 124000 casos en Japón(17).
Inhibidores ROCK y la córnea
Es importante destacar que las células endoteliales corneales humanas (CECH) se detienen en la fase G1 del ciclo celular(21), lo que sugiere que no se diferencian terminalmente sino que tienen potencial proliferativo(20). El hecho de que las células endoteliales corneales (CEC) muestren actividad de proliferación en el cultivo in vitro sugiere que el endotelio corneal tiene la posibilidad de proliferar en una condición apropiada, incluso in vivo(17,19). La pérdida patológica de células CEC provoca una migración compensatoria concurrente y la ampliación de las CEC restantes para lograr la monocapa funcional inhibida por contacto(19).
Diferentes investigadores analizando varios compuestos químicos de bajo peso molecular, encontraron que la modulación de la señalización Rho / ROCK era importante para numerosas funciones celulares, y que por lo tanto la vía ROCK podría ser un posible objetivo terapéutico para el tratamiento de la enfermedad endotelial corneal(17,18,19,20,22) ya que en los casos de disfunción endotelial corneal en etapa temprana, en la cual todavía se mantienen células madre o células progenitoras en el tejido, la terapia con medicamentos puede proporcionar un tratamiento menos invasivo o antiprogresión(19).
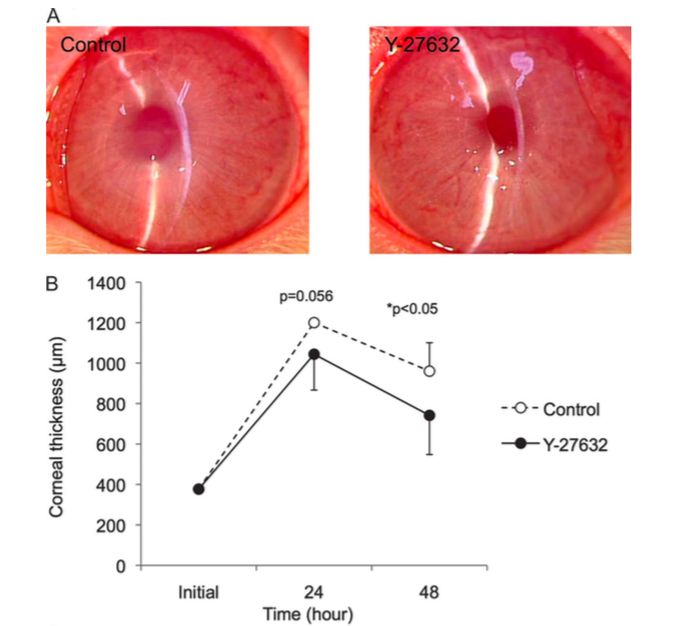
Okumura et al(22,23) examinaron fármacos in vitro utilizando CEC y demostraron que un inhibidor específico de la Rho quinasa (ROCK), el Y-27632, aumentaba la proliferación celular de las CEC cultivadas en primates. Posteriormente también demostraron su uso in vivo aplicando tópicamente 10 mM de Y-27632/ 6 veces al día durante un período de 2 días después de la creación de una herida endotelial corneal en conejos.
Mediante el examen microscópico con lámpara de hendidura demostraron que la transparencia corneal y el grosor corneal se recuperaba de forma más rápida en el grupo Y-27632 en comparación con el grupo control. La paquimetría ultrasónica también reveló que el grosor de la córnea era significativamente menor en el grupo Y-27632 en comparación con el grupo de control después de 48 horas de tratamiento
Además, la aplicación tópica de Y-27632 promovía la cicatrización de la herida endotelial en un modelo animal in vivo por lo que propusieron que la instilación tópica del inhibidor ROCK, Y-27632, podría ser una modalidad terapéutica clínicamente aplicable y menos invasiva para el tratamiento de la disfunción endotelial corneal(17,22).
MECANISMO MOLECULAR DE ACCIÓN DE LOS INHIBIDORES DE ROCK EN LA PROLIFERACIÓN DE LAS CEC
El concepto de tratamiento con gotas oculares es recuperar la función endotelial de la córnea estimulando la proliferación in vivo de CEC residuales en pacientes. Con este objetivo, Koizumi et al(20) examinaron el efecto tópico de un inhibidor del inhibidor ROCK Y-27632 en las CEC utilizando un modelo con un defecto endotelial corneal parcial en córneas de conejos.
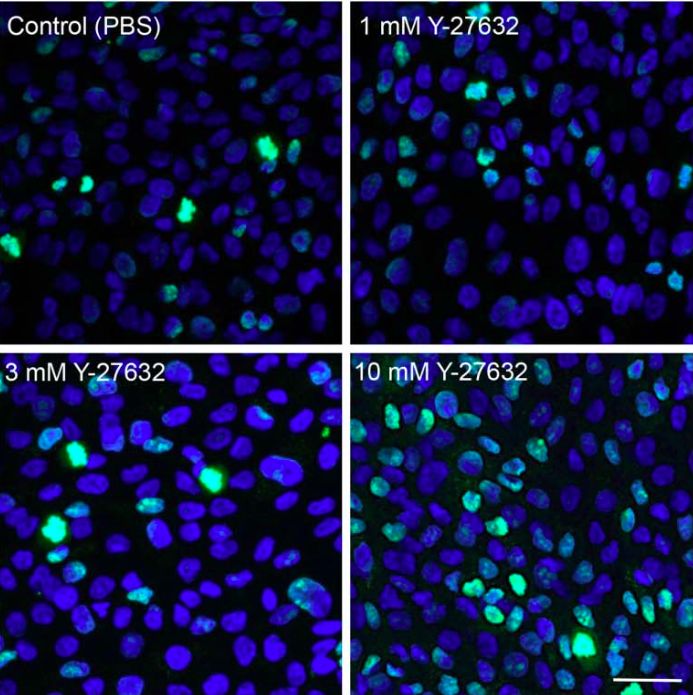
Los ojos tratados con Y-27632 mostraron menos edema corneal y el área media de la herida fue significativamente menor que la de los ojos de control. También confirmaron que la proliferación de CEC de conejo se incrementó con la aplicación de Y-27632 de una manera dosis dependiente. Estos resultados demostraron que la administración tópica del inhibidor selectivo de ROCK, Y-27632, promovió la cicatrización de la herida endotelial de la córnea al estimular la proliferación de CEC. Sobre la base de estos hallazgos, investigaron la aplicación de gotas oculares de un inhibidor de ROCK en un entorno clínico y realizaron un experimento similar utilizando un modelo de disfunción parcial endotelial en córneas de monos cuyas CEC no proliferan bien in vivo. La aplicación tópica de las gotas oculares Y-27632 mejoró en gran medida la cicatrización de las heridas del endotelio corneal y permitió que el endotelio corneal retuviera una alta densidad celular 1 mes después del tratamiento.
De forma similar, Okumara et al(19) usando un modelo de disfunción endotelial en córneas de primates, demostraron que: la aplicación tópica de Y-27632 mejoraba en gran medida la cicatrización de las heridas del endotelio corneal; que el endotelio corneal regenerado de la región dañada central demostrada una morfología celular hexagonal fisiológica y se reanudaban los perfiles característicos de adhesión (ZO-1 y Na + / K + ATPasa) y del citoesqueleto de actina cuando se trataban con gotas de Y-27632.
Aunque las células madre endoteliales de la córnea no se han identificado específicamente y no se ha determinado su ubicación exacta, varios grupos informaron que las CEC en el área periférica de la córnea conservaban una alta capacidad proliferativa.
Recientemente el grupo de Okumara-Koizumi-Kinoshita informó que el marcador, LGR5, se expresa de forma única en las lesiones periféricas de las CEC humanas y que las células LGR5 positivas tienen algunas características típicas de las células madre / progenitoras. Aunque su hallazgo clínico proporciona evidencia indirecta, sugiere fuertemente que la inhibición de ROCK estimula la proliferación in vivo de las CEC. Estos casos demuestran la posibilidad de un tratamiento médico exitoso que implique el uso de gotas oculares inhibidoras ROCK u otros agentes farmacológicos como alternativa a la cirugía de injerto para las fases tempranas de la disfunción endotelial corneal.
¿Son las gotas oculares inhibidoras ROCK clínicamente útiles para el tratamiento de la distrofia corneal endotelial de Fuchs?
Posteriormente el mismo grupo demostró la eficacia Y-27632 en el tratamiento de pacientes con edema corneal central causado por la distrofia corneal de Fuchs.
Sobre la base de los resultados obtenidos en estudios previos con animales, realizaron un estudio en el que se incluyeron ocho ojos de ocho pacientes programados inicialmente para DSAEK.
Cuatro ojos presentaban edema corneal difuso causado por la queratopatía bullosa inducida por iridotomía con láser de argón o queratopatía en el síndrome de pseudoexfoliación. Los otros cuatro ojos tenían edema corneal central causado por un inicio tardío de la distrofia corneal de Fuchs.
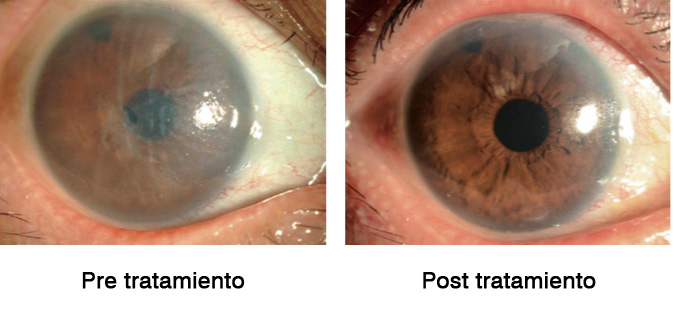
Todos los ojos se sometieron a congelación transcorneal utilizando una varilla de acero inoxidable de 2 mm de diámetro, seguida de la aplicación de gotas para ojos Y-27632 6 veces al día durante 1 semana. Los cuatro pacientes con edema corneal difuso no mostraron reducción del grosor corneal ni mejoría en la agudeza visual. Sin embargo, tres de los cuatro ojos con edema corneal central causado por distrofia corneal de Fuchs mostraron una disminución en el grosor corneal central, que además se mantuvo en el tiempo.
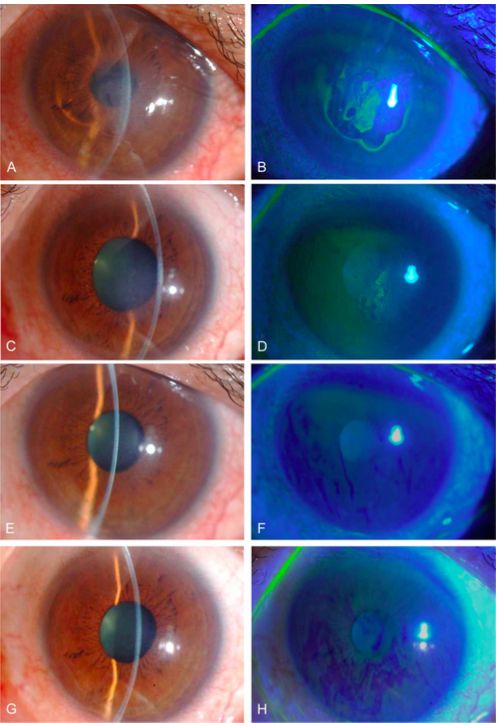
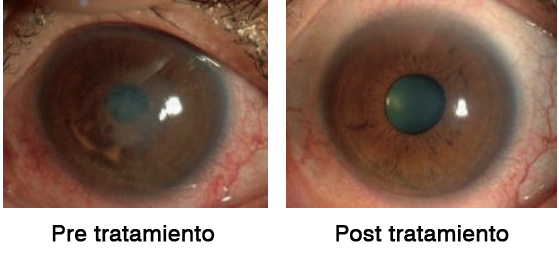
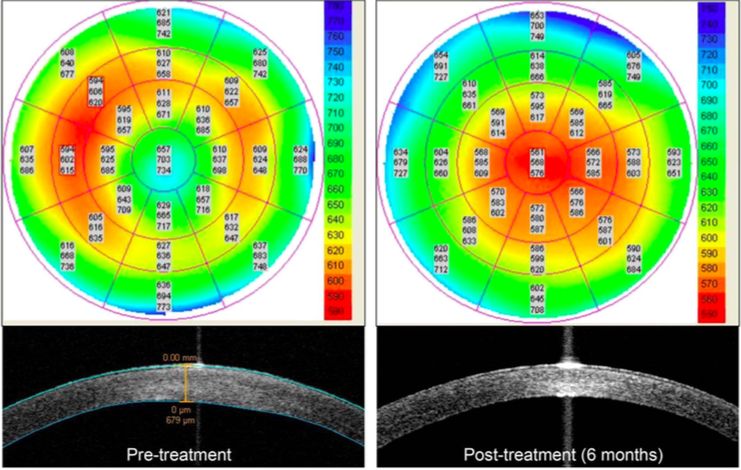
El mismo grupo de Okumara et al(19), también quiso probar si esta administración tópica del inhibidor ROCK mejoraba la proliferación de CEC in vivo. En este ensayo clínico participaron cuatro pacientes con edema corneal central y cuatro pacientes con edema corneal difuso. Los pacientes fueron tratados con el inhibidor de ROCK tópica, seis veces al día durante siete días. El resultado fue que se consiguió una recuperación de la transparencia corneal y una reducción gradual del edema corneal central en pacientes humanos con disfunción endotelial.
Estos hallazgos sugieren de nuevo que el uso tópico de Y-27632 podría ser clínicamente beneficioso para un cierto grupo de pacientes con edema central causado por una disfunción endotelial, por ejemplo en pacientes con distrofia de Fuchs(19).
¿Son efectivas las gotas oculares inhibidoras ROCK para prevenir la descompensación corneal post cirugía de catarata?
Aunque actualmente no está autorizado, otra posible indicación de la administración de los inhibidores de ROCK es el daño endotelial corneal agudo, especialmente el que ocurre durante la cirugía de catarata. La descompensación de la córnea después de la cirugía de cataratas es una de las principales causas de trasplante de córnea en muchos países, ya que representa el 12,2% y el 20-40% de los trasplantes de córnea realizados en los Estados Unidos y en los países asiáticos, respectivamente.
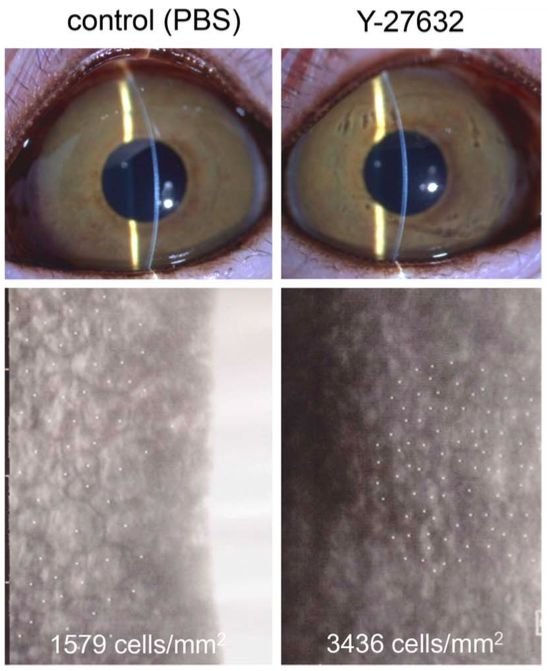
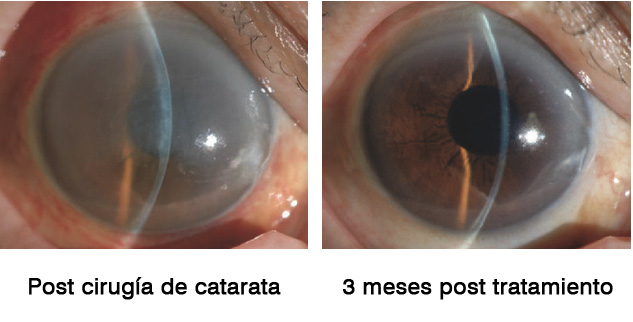
En el estudio de Okumara et al(19) dos pacientes fueron remitidos a la clínica de córnea en la Universidad de Medicina de la Prefectura de Kyoto después de que más de la mitad de la membrana de Descemet se desprendiera accidentalmente durante la cirugía de catarata. Un paciente adicional se había sometido a una cirugía de catarata y la extirpación de un quiste del iris que se había formado después de un traumatismo ocular anterior y casi la mitad del área de la córnea estaba expuesta en el lugar donde se extrajo el quiste del iris. Los tres pacientes mostraron un edema corneal severo después de la cirugía y tuvieron un alto riesgo de descompensación corneal posterior. La administración de gotas oculares con inhibidor de ROCK condujo a la recuperación de la transparencia corneal en 1-3 meses en los tres ojos. Aunque, se necesitan ensayos clínicos aleatorios adicionales para validar estos hallazgos y confirmar la efectividad de los inhibidores ROCK como tratamiento para el daño endotelial corneal post cirugía, los hallazgos positivos de estos casos clínicos preliminares han motivado al grupo de Kinoshita y Okumara a desarrollar inhibidores ROCK como medicamentos para el tratamiento del daño endotelial corneal tras la cirugía de cataratas.
Las gotas oculares de ripasudil fueron aprobadas en Japón como solución oftálmica GLANATEC® al 0,4% para el tratamiento del glaucoma y la hipertensión ocular. Como hemos mencionado previamente en experimentos con conejos, demostraron que el ripasudil muestra efectos similares en la cicatrización de las heridas endoteliales de la córnea que otros inhibidores de la ROCK(20,24,25). Por lo tanto, el reposicionamiento de ripasudil como un fármaco para el tratamiento de las enfermedades endoteliales de la córnea parece ser una estrategia posible para llevar los inhibidores de la ROCK rápidamente a entornos clínicos(20,24,25).
COMBINACIÓN DE INHIBIDORES ROCK CON EXTRACCIÓN ÚNICA DE LA MEMBRANA DE DESCEMET
Macsai et al(25) evaluaron el uso de inhibidores tópicos de la ROCK en pacientes con distrofia de Fuchs que se sometían a la extracción de la membrana Descemet únicamente (por sus siglas en inglés DSO) al tratar a pacientes después de DSO con o sin ripasudil tópico. Asignaron nueve pacientes al grupo sin ripasudil (observación) y otros nueve al grupo de ripasudil después de la DSO.
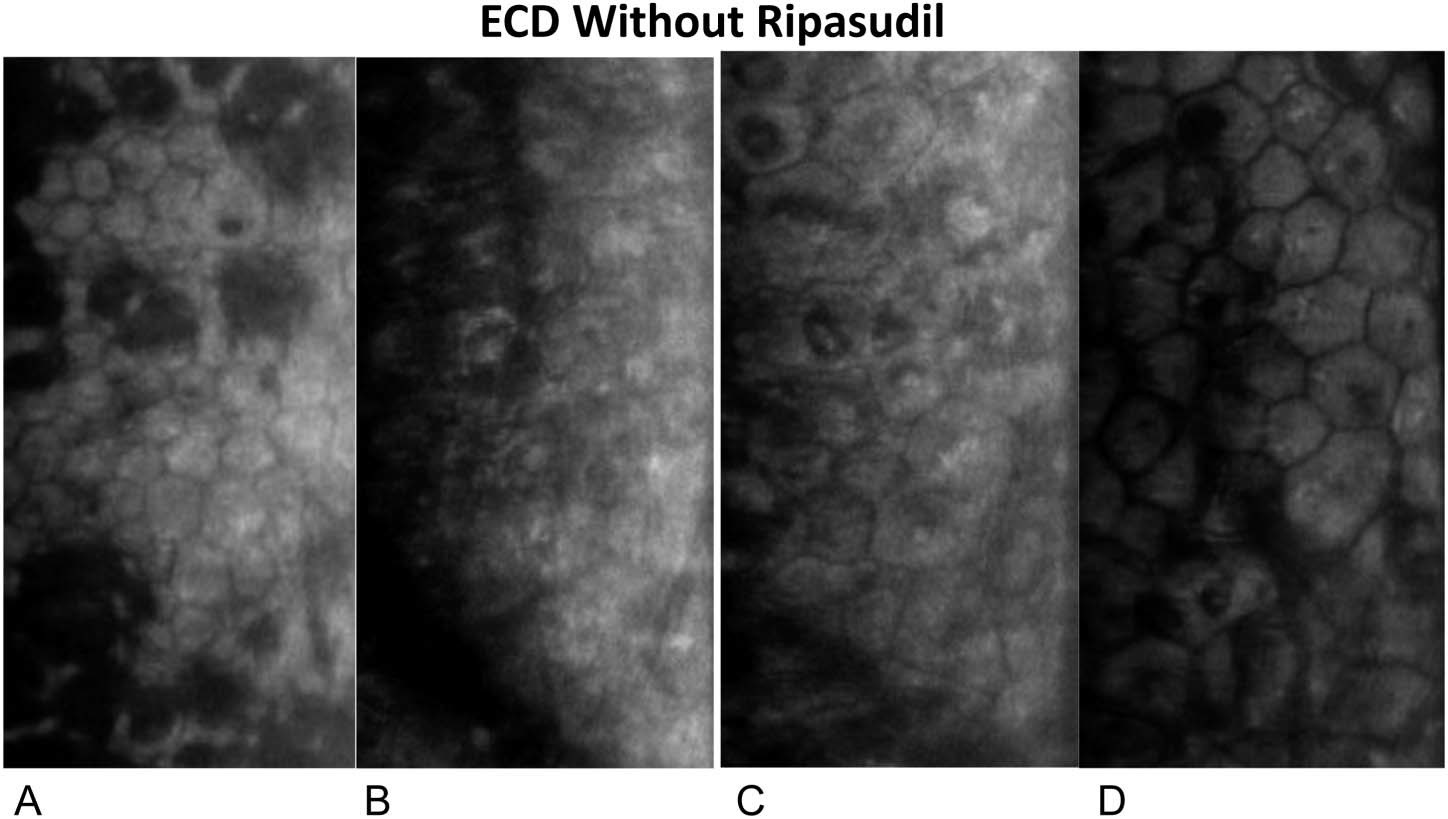
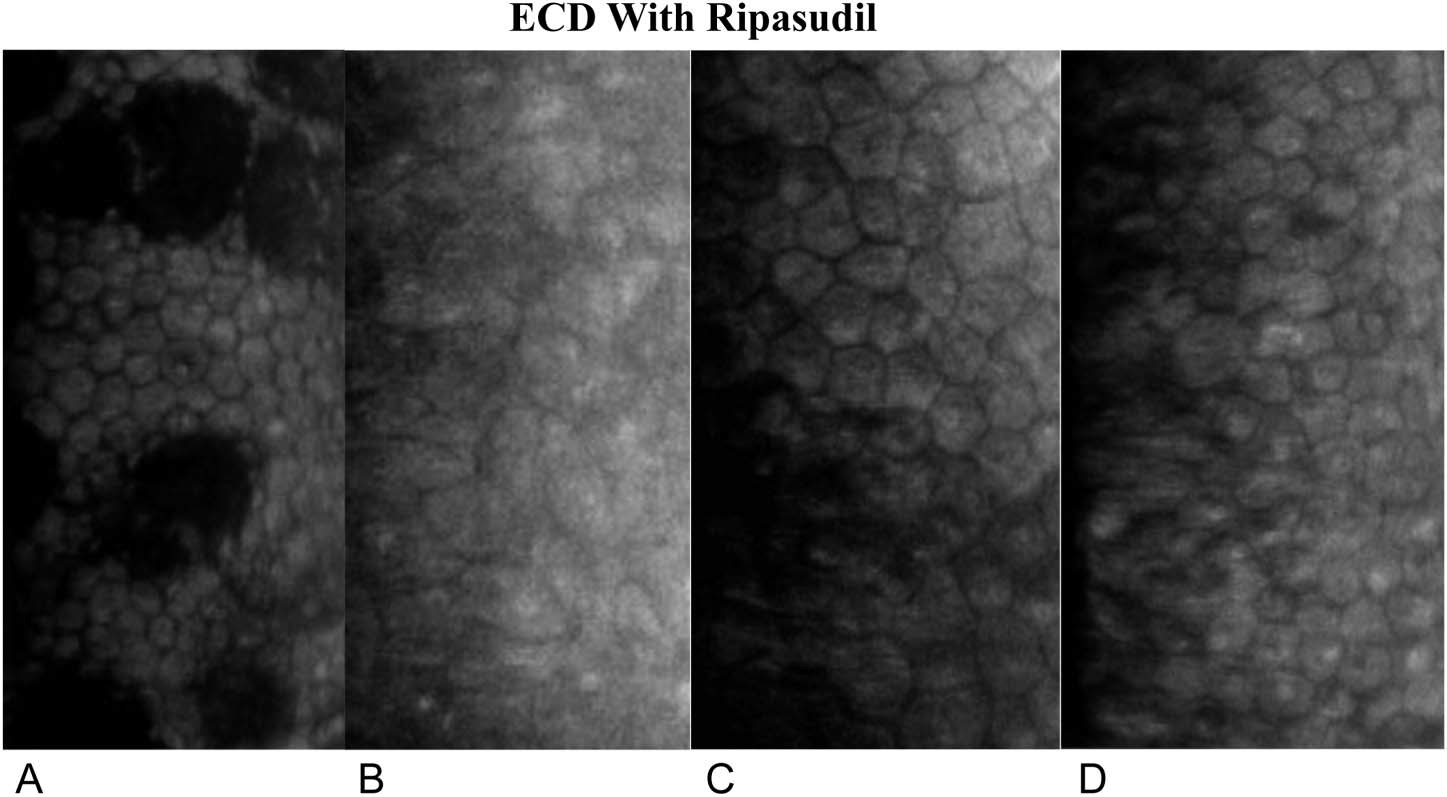
En este estudio, la aplicación de ripasudil tópico en pacientes sometidos a DSO resultó en una recuperación visual más rápida, un ECD central más alto a 1 año y en una menor pérdida de ECD periférica.
Las ventajas de DSO con o sin el uso de inhibidores tópicos rho quinasa representan un tratamiento alternativo excitante para los pacientes con distrofia de Fuchs con respecto al trasplante corneal que puede llevar riesgos. Estos riesgos incluyen la transmisión de enfermedades, queratitis infecciosa y la aplicación de gotas de corticosteroides durante toda la vida para reducir la posibilidad de rechazo del tejido trasplantado. Por lo tanto, se evita el riesgo de aumento de la presión intraocular y la formación de cataratas por el uso a largo plazo de corticosteroides tópicos. Además, la DSO con inhibidores tópicos ROCK podrían mejorar los resultados visuales y reducir otras complicaciones conocidas de la queratoplastia endotelial. La restauración del endotelio corneal sin tejido del donante puede reducir las aberraciones de orden superior y la dispersión de la luz que se sabe que reducen la agudeza visual después del DSAEK/DMEK y eliminar cualquier dispersión causada por la interfaz donante-huésped(28,29).
Macsai et al(25) refieren que si los 5 mm centrales de la membrana de Descemet se extraen de una córnea de 12 mm, aproximadamente el 17% de las células endoteliales se eliminan, asumiendo la misma ECD en las córneas central y periférica. Por lo tanto, se esperaría una disminución del 10% en la córnea periférica después del DSO cuando haya una migración de las células endoteliales periféricas para cubrir el área central de la membrana descapada de Descemet. La falta de disminución de la densidad de células endoteliales periférica en el grupo de DSO tratado con ripasudil puede respaldar el concepto de proliferación de células endoteliales en este grupo, a diferencia de la migración de células endoteliales en el grupo de DSO. Por lo tanto, el tamaño de la descemetorhexis puede limitar la capacidad del endotelio para recuperarse de manera oportuna. Además, el borde liso de la descemetorhexis y las fibras estromales subyacentes no interrumpidas parecen mejorar la capacidad de la célula endotelial para migrar sobre el área denudada. Por lo tanto, creen que es fundamental eliminar sólo la porción central de la membrana de Descemet y el endotelio, dejando un borde liso de descemetorhexis y sin interrupción de las fibras estromales subyacentes. Descubrieron que esto se lograba mejor mediante la aspiración lenta y constante de la membrana con la pieza de mano de irrigación/aspiración unidad de facoemulsificación, mientras se va desgarrando la membrana de Descemet en un patrón curvilíneo similar a la formación de la capsulorrexis en la cirugía de catarata(25).
Este grupo además propone que desde una perspectiva social, la DSO con inhibidores tópicos de la Rho Kinasa podría disminuir el costo de la rehabilitación visual tanto para el paciente de forma individual como para la sociedad en general. El costo de un procedimiento de cirugía endotelial se estimó entre $ 16,000 y $ 21,000 en 2015(31). El DSO es más barato que las terapias convencionales debido a que no requiere de un tejido corneal donante lo que resulta en menores costos médicos. En pacientes tratados con ripasudil, el costo del medicamento fue de $400.
El tratamiento con inhibidores ROCK permite la terapia basada en células
La ingeniería tisular se ha anticipado como una nueva terapia que puede reemplazar el trasplante de córnea convencional utilizando córneas de donantes. Al menos dos estrategias posibles están disponibles para trasplantar CEC cultivadas a córneas receptoras(26). Una estrategia es hacer una lámina endotelial corneal cultivada y trasplantarla en un procedimiento similar al DSEK o DMEK. Okumara et al así como otros investigadores han cultivado CEC en un sustrato y la han trasplantado la hoja resultante de CEC en modelos animales(19). La lámina de CEC transplantada regeneró la córnea en estos modelos animales, sin embargo el trasplante de esta lámina compuesta por una monocapa es frágil y la unión a la parte posterior de la córnea implican técnicas quirúrgicas difíciles(19).
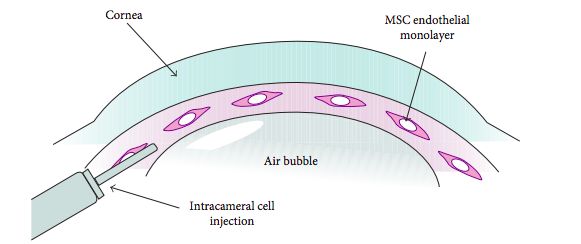
La segunda estrategia es inyectar CEC cultivadas en forma de una suspensión celular en la cámara anterior. Las CEC inyectadas en la cámara anterior no se unirán espontáneamente a la capa epitelial de la córnea receptora, por lo que se propuso la guía magnética o la inyección CEC esféricas para mejorar el injerto de CEC.
Okumara et al(26) consideran que la inyección celular tiene varias ventajas sobre el trasplante de láminas de CEC: se trataría de un procedimiento de trasplante simplificado, menos invasivo para los pacientes, con una preparación más fácil y la evitación del uso de sustratos artificiales. Su hallazgo en el que demostraron que el tratamiento con inhibidores de ROCK mejora la adhesión de las CEC a un sustrato(23) les llevó a iniciar experimentos con animales a los que se inyectaron CEC cultivadas en la cámara anterior en combinación con un inhibidor de ROCK y demostraron la regeneración del endotelio corneal y la restauración de la transparencia corneal(19,27). Desde entonces, han acumulado pruebas que confirman la seguridad y la eficacia de las inyecciones de CEC cultivadas en combinación con un inhibidor de ROCK en modelos animales.
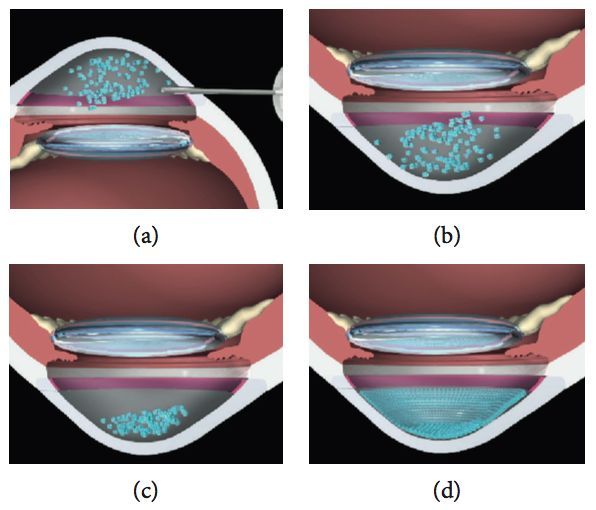
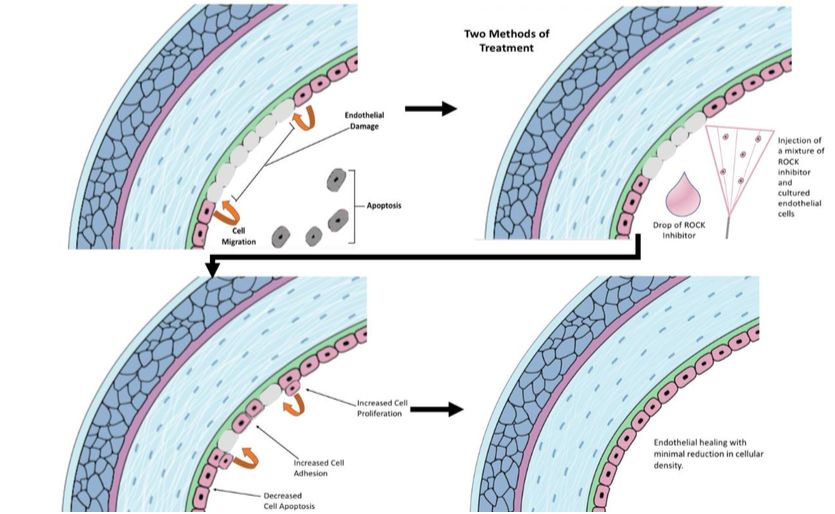
Células madres mesenquimales y córnea
Las células endoteliales corneales humanas (CECH) se pueden aislar de córneas de donantes con la aplicación de EDTA, tripsina o colagenasa II. Además, a través de la prueba en diferentes factores de cultivo (como medios de cultivo basales, aditivos y métodos de modulación de medios), se han desarrollado varios entornos de crecimiento para permitir la expansión de CECH (tales como el estroma corneal humano, colágeno, membrana amniótica y polímeros biodegradables)(28).
Las células madre mesenquimales (CMS) pueden obtenerse fácilmente de diferentes tejidos humanos, y su aplicación (de manera similar a otros tipos de células pluripotentes) parece más factible si se compara con las células endoteliales corneales humanas primarias, que como hemos mencionado tienen capacidades proliferativas limitadas. Las CMS se han administrado a través de dos vías diferentes: una local (mediante la inyección directa o mediante siembra celular) y una sistémica (introducción intravenosa o intraarterial)(28). El potencial de la alteración fenotípica de las células madre mesenquimales hacia células endoteliales corneales humanas se basa en el hecho de que durante el desarrollo del ojo en muchas especies, incluidos los humanos, las células endoteliales corneales se diferencian de las células mesenquimales perioculares derivadas de la cresta neural (este desarrollo embrionario también está respaldado por varios hallazgos inmunohistoquímicos)(28). Además, las CMS y las CEC humanas comparten algunas características mesenquimales (ya que las CEC pueden alterar su forma hasta convertirse en una fibroblasto y pueden producir colágeno de tipo IV, en presencia de FGF y matriz extracelular fibroblástica]) y son capaces de expresar proteínas de adhesión tales como ZO1 y N-cadherina. Sin embargo, la diferenciación dirigida de las CEC no se ha identificado claramente y la capacidad para detectar claramente un clon CEC definitivo derivado de fuentes pluripotentes o de células madre es aún insuficiente(28).
La aplicación de células madre mesenquimales para el reemplazo endotelial de la córnea se puede considerar como una perspectiva prometedora, incluso si su potencial aún no se ha evaluado funcionalmente con estudios adicionales en modelos animales in vivo(28).
En primer lugar, reduce la necesidad de córneas donantes, ahorrando recursos cada vez más limitados en el tiempo. Además, las células madre mesenquimales autólogas se pueden extraer del mismo paciente, que puede actuar como donante y como sujeto receptor, lo que reduce aún más las tasas de rechazo y las reacciones inmunológicas. Dado que estas células se pueden inyectar en la cámara anterior, los problemas técnicos relacionados con la cirugía se reducen (sin un colgajo corneal que deba manejarse con cuidado). Además, se pueden realizar inyecciones repetidas, si es necesario (como en caso de fallo o recurrencia), después de una segunda extracción de células o después de la expansión de CMS (que puede funcionar como una muestra de reservorio). La adhesión de las CMS también se puede promover mediante el recubrimiento con anticuerpos específicos para las proteínas de adhesión endotelial, mejorando la orientación de las CMS a las áreas heridas. Además, las inyecciones de CMS pueden prevenir el fallo del trasplante endotelial debido a la deficiencia celular que puede ocurrir en las córneas del donante por modificaciones relacionadas con la edad. Por esta razón, la terapia de células endoteliales puede considerarse también como una terapia adyuvante después de DMEK y no solo como un enfoque de primer paso(28).
CONCLUSIÓN
Como podemos observar ha habido un gran avance en los últimos años respecto al manejo de la disfunción endotelial, desde la queratoplastia penetrante pasando por la queratoplastia endotelial hasta actualmente donde observamos que hay nuevos y excitantes tratamientos para la disfunción endotelial con nuevas terapias que intentan evitar las complicaciones derivadas del trasplante corneal, especialmente útil en el caso de la distrofia endotelial de Fuchs.
BIBLIOGRAFÍA
- Gain, Philippe & Jullienne, Rémy & He, Zhiguo & Aldossary, Mansour & Acquart, Sophie & Cognasse, Fabrice & Thuret, Gilles. (2015). Global Survey of Corneal Transplantation and Eye Banking. JAMA ophthalmology. 1-8. 10.1001/jamaophthalmol.2015.4776.
- Eye Bank Association of America. 2016 Eye Banking Statistical Report. Washington, DC: Eye Bank Association of America; 2016.
- Dickman MM, Kruit PJ, Remeijer L, et al. A randomized multicenter clinical trial of ultrathin Descemet stripping automated endothelial keratoplasty (DSAEK) versus DSAEK. Ophthalmology 2016; 123(11):2276-2284. 7.
- Neff KD, Biber JM, Holland EJ. Comparison of central corneal graft thickness to visual acuity outcomes in endothelial keratoplasty. Cornea 2011; 30:388-391.
- Chamberlain W, Lin CC, Austin A, Schubach N, Clover J, McLeod SD, Porco TC, Lietman TM, Rose-Nussbaumer J. Descemet Endothelial Thickness Comparison Trial: A Randomized Trial Comparing Ultrathin Descemet Stripping Automated Endothelial Keratoplasty with Descemet Membrane Endothelial Keratoplasty. Ophthalmology. 2019 Jan;126(1):19-26.
- Zafrakis P, Kymionis GD, Grentzelos MA, Livir-Rallatos G. Corneal graft detachment without corneal edema after Descemet stripping automated endothelial keratoplasty. Cornea 2010; 29:456–458.
- Balachandran C, Ham L, Verschoor CA, et al. Spontaneous corneal clearance despite graft detachment in Descemet membrane endothelial keratoplasty (DMEK). Am J Ophthalmol 2009; 148:227–234.
- Birbal RS, Parker J, Dirisamer M, et al. Descemet Membrane Endothelial Transfer: Ultimate Outcome. Cornea. 2018;37(2):141-144.
- Arbelaez JG, Price MO, Price FW Jr. Long-term follow-up and complications of stripping Descemet membrane without placement of graft in eyes with Fuchs endothelial dystrophy. Cornea. 2014;33:1295–1259
- Davies E, Jurkunas U, Pineda R. Predictive factors for corneal clearance after descemetorhexis without endothelial keratoplasty. Cornea. 2018;37(2):137-140.
- Iovieno A, Neri A, Soldani AM, et al. Descemetorhexis without graft placement for the treatment of Fuchs endothelial dystrophy: preliminary results and review of the literature. Cornea. 2017;36:637–641.
- Zygoura V, Baydoun L, Ham L, et al. Quarter-Descemet membrane endothelial keratoplasty (Quarter-DMEK) for Fuchs endothelial corneal dystrophy: 6 months clinical outcome. Br J Ophthalmol 2018;102:1425–1430.
- Birbal R, Hsien S, Zygoura V, et al. Outcomes of Hemi-Descemet Membrane Endothelial Keratoplasty for Fuchs Endothelial Corneal Dystrophy. Cornea. 2018 37(7), 854-858.
- Stuart AJ, Romano V, Virgili G, Shortt AJ. Descemet’s membrane endothelial keratoplasty (DMEK) versus Descemet’sstripping automated endothelial keratoplasty (DSAEK) for corneal endothelial failure.Cochrane Database of Systematic Reviews 2018,Issue 6
- 17- Hall A. Rho GTPases and the actin cytoskeleton. Science. 1998;279(5350):509-14. pmid: 9438836
- Moshirfar M, Parker L, Birdsong OC , Ronquillo YC , Hofstedt D, Shah TJ et al. Use of Rho kinase Inhibitors in Ophthalmology: A Review of the Literature. Med Hypothesis Discov Innov Ophthalmol 18; 7 (3)
- Okumura N, Koizumi N, Ueno M, Sakamoto Y, Takahashi H, Hirata K, et al. Enhancement of corneal endothelium wound healing by Rho-associated kinase (ROCK) inhibitor eye drops. Br J Ophthalmol 2011;95:1006e1009. doi:10.1136/bjo.2010.194571
- Okumura N, Kinoshita S, Koizumi N. Application of Rho Kinase Inhibitors for the Treatment of Corneal Endothelial Diseases. Journal of Ophthalmology Volume 2017, Article ID 2646904, 8 pages https://doi.org/10.1155/2017/2646904
- Okumura N, Koizumi N, Kay EP, Ueno M, Sakamoto Y, Nakamura S et al. The ROCK Inhibitor Eye Drop Accelerates Corneal Endothelium Wound Healing. Invest Ophthalmol Vis Sci. 2013;54:2439–2502. DOI:10. 1167/iovs.12-11320
- Koizumi N, Okumura N, Ueno M, et al. Rho-associated kinase inhibitor eye drop treatment as a possible medical treatment for Fuchs corneal dystrophy. Cornea. 2013;32:1167–1170. Koizumi N, Okumura N, Ueno M, Kinoshita S. New Therapeutic Modality for Corneal Endothelial Disease Using Rho-Associated Kinase Inhibitor Eye Drops. (Cornea 2014;33(Suppl):S25–S31)
- Joyce NC. Proliferative capacity of the corneal endothelium. Prog Retin Eye Res. 2003;22:359–389.
- Okumura N, Koizumi N, Ueno M, Sakamoto Y, Takahashi H, Hamuro J, et al. The New Therapeutic Concept of Using a Rho Kinase Inhibitor for the Treatment of Corneal Endothelial Dysfunction. (Cornea 2011;30(Suppl. 1):S54–S59
- Okumura, M. Ueno, N. Koizumi et al., “Enhancement on primate corneal endothelial cell survival in vitro by a ROCK inhibitor,” Investigative Ophthalmology & Visual Science, vol. 50, no. 8, pp. 3680–3687, 2009.
- Okumura, Y. Okazaki, R. Inoue et al., “Effect of the Rho- associated kinase inhibitor eye drop (ripasudil) on corneal endothelial wound healing,” Investigative Ophthalmology & Visual Science, vol. 57, no. 3, pp. 1284–1292, 2016.
- Macsai MS and Shiloach M. Use of Topical Rho Kinase Inhibitors in the Treatment of Fuchs Dystrophy After Descemet Stripping Only. Cornea 2019;38:529–534
- Okumura, S. Kinoshita, and N. Koizumi, “Cell-based approach for treatment of corneal endothelial dysfunction,” Cornea, vol. 33, Supplement 11, pp. S37–S41, 2014
- Okumura,Y.Sakamoto,K.Fujiietal.,“Rho kinase inhibitor enables cell-based therapy for corneal endothelial dysfunc- tion,” Scientific Reports, vol. 6, p. 26113, 2016.
- Marolo NR, Tridico F. From DMEK to Corneal Endothelial Cell Therapy: Technical and Biological Aspects. Journal of Ophthalmology Volume 2018, Article ID 6482095, 8 pages https://doi.org/10.1155/2018/6482095
- Carnahan MC, Goldstein DA. Ocular complications of topical, peri-ocular and systemic corticosteroids. Curr Opin Ophthalmol. 2000;11:478–483.
- Patel SV, Baratz KH, Hodge DO, et al. The effect of corneal light scatter on vision after Descemet stripping with endothelial keratoplasty. Arch Ophthalmol. 2009;127:153.
- The Lewin Group Inc. Cost-benefit analysis of corneal transplant. [Eye Bank Association of America website]. 2013. Available at: http://restoresight.org/wp-content/uploads/2014/03/Lewin-Study-Sept-2013.pdf. Accessed October 31, 2018.
AUTORES

Carlos Rocha de Lossada
– Hospital Regional Universitario de Málaga

Marina Rodríguez Calvo de Mora MD, PhD, FEBO
– Subespecialista en córnea Hospital Regional Universitario de Málaga

Rahul Rachwani Anil
– Residente 3 año Hospital Regional Universitario de Málaga