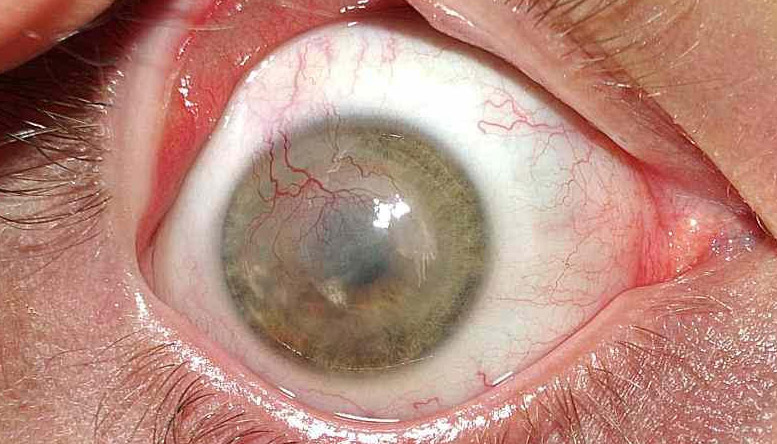
La pregunta que lanzaba al foro es acerca de la experiencia, vía y dosificación del tratamiento de la neovascularización corneal con fármacos anti-VEGF.
Se recibieron varias respuestas que pasamos a resumir:
Inició el Dr. Jose Vicente Rodríguez comentando que había utilizado en varios casos el Bevacizumab y que siempre infiltraba en plano corneal y subconjuntival muy cerca de limbo con buenos resultados.
El Dr. Noé Rivero apostillaba indicando que los antiangiogénicos funcionan en neovasos, es decir, vasos nuevos en formación, no en vasos ya maduros que contengan ya formados los pericitos en la lamina basal de las células endoteliales.
El Dr. Randal Ulate, cuando el tronco vascular es grande, lo cauteriza de preferencia con el electrocauterio monopolar de punta fina. Si tiene que inyectar anti-VEGF, la aguja la introduce por conjuntiva y la inyección la hace intraestromal. Su protocolo es de una inyección mensual en tres meses y de esta forma, los que responden, que son casi el 80%, lo hacen en este período. Usa la misma cantidad que para una intravítrea, 0.1 cc. Adjunta además un vídeo sobre su técnica:
El Dr. Gegúndez utiliza igualmente la misma que en las intravítreas. En su caso 1.25 mg/0.05 ml ó 2.50 mg/0.1 ml.. Lo pide a la farmacia del hospital que le preparan una jeringa con 0.3 ml para tener suficiente.
Dado lo interesante del tema le hemos pedido al Dr. Javier García-Montesinos Gutiérrez de QVisión Almería nos hiciera una revisión de este tema tan interesante.
Introducción
La córnea constituye la primera lente del sistema óptico ocular. Una de sus principales características y que le permite realizar su función es la transparencia.
La cornea es transparente debido a la disposición estructural de las láminas o lamelas de colágeno que la forman y gracias a la ausencia de vasos sanguíneos y linfáticos.
Aunque estrictamente deberíamos de referirnos a esta entidad como vascularización corneal, ya que la córnea sana es avascular de por sí, en la mayoría de publicaciones científicas y entre la mayoría de oftalmólogos se usa con mayor frecuencia el término neovascularización corneal (NVC), por lo que lo seguiremos utilizando a lo largo de esta revisión.
Antes de hablar de los mecanismos de neovascularización corneal es necesarios definir dos tipos de procesos de formación de neovasos:
- Vasculogénesis: formación de vasos sanguíneos de novo a partir de células precursoras endoteliales, que derivan del mesodermo.
- Angiogénesis: formación de nuevos vasos a partir de proliferación de células endoteliales de vasos pre-existentes.
En la neovascularización corneal intervienen procesos de angiogénesis desde vasos limbares, pero también de vasculogénesis que aportan los pericitos a los nuevos vasos.
Hemangiogénesis y linfangiogénesis (1, 2)
También es necesarios diferenciar entre la formación de vasos sanguíneos (hemangiogénesis) y la formación de vasos linfáticos (linfangiogénesis). Estos últimos permiten que antígenos procedentes de la córnea y a células presentadoras de antígenos alcanzar los ganglios linfáticos y activar una eventual respuesta inmunitaria específica (vía aferente). Mientras que a través de los vasos sanguíneos alcanzarían la córnea las células del sistema inmune (vía eferente). Se ha demostrado que la linfangiogénesis en la inducción de respuestas inmunes tras la queratoplastia
Experimentos en modelo animal de ratón de queratoplastia de bajo riesgo han demostrado que la linfangiogénesis acompaña siempre a la hemangiogénesis y se correlaciona significativamente con la ésta, si bien es cierto que la formación de vasos linfáticos puede producirse en corneas avasculares. Los vasos linfáticos corneales son invisibles y no se pueden detectar en el examen con lámpara de hendidura, aunque se pueden demostrar en estudios de anatomía patológica a través de marcadores específicos del endotelio linfático, y en vivo mediante microscopía confocal.
En comparación con los vasos sanguíneos, los linfáticos aparecen antes tras un corto periodo de estímulo inflamatorio y tienden a regresar de forma mucho más rápida una vez la noxa angiogénica-inflamatoria ha desaparecido. Este hecho va en línea con la práctica clínica de no realizar queratoplastias en caliente y esperar a que el ojo este “tranquilo” para mejorar la supervivencia del injerto.
La importancia de los vasos linfáticos y el riesgo de rechazo han sido puestos de manifiesto en algunos estudios en modelos animales en los que se conseguía una supervivencia del injerto “indefinida” cuando se extirpaba la cadena linfática cervical.
En otro interesante estudio en modelo animal de ratón se comparaba la supervivencia de queratoplastia en lecho avascular, lecho vascularizado con vasos sanguíneos y linfáticos y en lecho vascularizado con vasos sanguineos pero sin vasos linfáticos, inhibiendo selectivamente la linfangiogénesis. La supervivencia del injerto solo fue significativamente más baja en el grupo que presentaba vasos linfáticos y sanguíneos La supervivencia del grupo de córnea avascular era similar a la del grupo de córnea neovascularizada sin vasos linfáticos(3).
Los mecanismos de linfangiogénesis corneal son menos conocidos, pero se sabe que el VEGF juega también un papel fundamental en su formación.
Privilegio angiogénico corneal (1,2)
En condiciones fisiológicas existen una serie de mecanismos que evitan que vasos del plexo limbar invadan la córnea. Estos factores son además redundantes: el estímulo angiogénico tiene que ser muy intenso para que se produzca la NVC.
- Factores angiostáticos
La cornea contiene numerosos factores endógenos inhibitorios de la hemangiogénesis y linfangiogénesis (PEDF, angiostatina, endostatina, trombospondina 1 y 2). Estos factores se sitúan a nivel del endotelio y epitelio corneales para impedir que actúen estímulos angiogénicos internos o externos.
- Secuestro de factores angiogénicos
Aunque el epitelio corneal puede producir factores pro-angiogénicos, como el factor de crecimiento del endotelio vascular (VEGF), estos en condiciones normales son secuestrados por la membrana basal del epitelio y a través de diversas proteínas, como determinados receptores o receptores solubles que unen y neutralizan los factores angiogénicos.
- Función angiostática del limbo
El limbo esclerocorneal tiene una función de barrera anti-angiogénica física (por la renovación continua del epitelio corneal) y funcional. Esta función de barrera se pierde en la deficiencia de células madre limbares (DCML).
Mecanismos de neovascularización corneal (1)
La NVC se produce cuando existe un disbalance entre los factores anti-angiogénicos y los factores angiogénicos a favor de estos últimos debido principalmente a una alteración inflamatoria (queratitis), de la función de barrera limbar o a hipoxia.
- Inflamación
Constituye un mecanismo fundamental en la NVC de cualquier etiología (quemaduras químicas, infecciones, hipoxia, DCML, trastornos inmunes etc). El reclutamiento de células inflamatorias por estímulos nocivos a la córnea, sobre todo macrófagos, producen factores pro-angiogénicos (IL-1, TNF-alfa, VEGF…) y enzimas proteolíticas que favorecen la proliferación y migración de células endoteliales limbares.
- Deficiencia de células madre limbares
La destrucción directa de estas células madre limbares o de su microentorno da lugar a la insuficiencia límbica o deficiencia de células madre limbares (DCML) en la cual el hecho fisiopatológico fundamental es la incapacidad de regenerar las células del epitelio corneal de forma que aparecen células conjuntivales reemplazando el epitelio corneal normal(4).
La DCML puede ser congénita o adquirida, y se caracteriza por la perdida de la función de barrera del limbo esclerocorneal. Por ello se produce con frecuencia la conjuntivalización de la cornea y la NVC en mayor o menor grado(4,5).
- Hipoxia
Supone un estímulo angiogénico al inducir la expresión de factores que tratan de aumentar la llegada de oxigeno al tejido corneal como el VEGF, mediadores inflamatorios del ácido araquidónico o el factor inducible de hipoxia 1-alfa (HIF-1-alfa).
Uno de los factores más frecuentemente asociados a la hipoxia corneal es el uso de lentes de contacto. En estos pacientes se deberá suspender el uso de las mismas como primera medida terapéutica.
- Edema corneal
Debido a la desestructuración de las lamelas de colágeno el edema corneal favorece la neovascularización, aunque se ha visto que no es un factor suficiente por sí solo para producir NVC.
- Alteración de la inervación corneal
Produce disminución de factores angiostáticos que en condiciones normales son producidos por los nervios corneales.
En estas situaciones se produce una sobre-expresión de determinados factores angiogénicos por las células del epitelio corneal, las propias células inmunes reclutadas, el endotelio limbar, los fibroblastos corneales o incluso las células endoteliales. Entre estos factores se encuentran el VEGF, interleukina 1 y 6 (IL-1 e IL-6), factor de crecimiento fibroblástico (FGF), factor de necrosis tumoral-alfa (TNF-alfa), factor de crecimiento derivado de plaquetas (PDGF), óxido nítrico (ON), activación de la matriz de metaloproteinasas (MMP) que tienen diferentes funciones en el proceso de la angiogénesis.
De estos nos gustaría destacar el papel del VEGF (concretamente el VEGF-A) por su vital importancia en la formación y maduración de los vasos sanguíneos. El VEGF se ve sobre-expresado en las patologías que producen NVC, y procede de células epiteliales, estromales, endoteliales, células inflamatorias y endoteliales.
Realiza su función a través de 2 receptores que se expresan en las células endoteliales: VEGFR-1 y 2. VEGFR-1 tiene mucha más afinidad que VEGFR-2, aunque la actividad angiogénica se debe a VEGFR-2, teniendo VEGFR-1 un papel regulador. La activación de VEGFR-2 en el endotelio vascular produce actividad proteolítica, proliferación, migración, tubulación de células endoteliales y maduración vascular.
IMPORTANCIA DE LA NEOVASCULARIZACIÓN CORNEAL
La NVC puede producir desde disminución de la agudeza visual (AV) a ceguera, por disminución de la transparencia corneal por los propios neovasos o por exudación (son vasos inmaduros con tendencia a la fuga) de suero (edema corneal) o lípidos (queratopatía lipídica), fibrosis, generación de irregularidades de superficie y astigmatismo regular etc. En estos casos el tratamiento de la NVC va encaminado a mejorar la AV(2).
Además, la NVC constituye el principal factor de riesgo de rechazo inmune de una queratoplastia. En el contexto de “cornea de alto riesgo de rechazo” se produce una pérdida del privilegio angiogénico corneal tras el trasplante y vasos sanguíneos y linfáticos invaden el injerto aumentando el riesgo de rechazo. La profundidad y extensión de la NVC se correlaciona con el riesgo de rechazo. Además, una vez el rechazo inmune ocurre, la dificultad para revertirlo también va a depender del grado de neovascularización corneal(6). Más del 50% de pacientes con queratoplastia de bajo riesgo (aquella que se realiza sobre un lecho avascular y no inflamado) desarrollan angiogénesis durante el primer año. En el 10% de los casos estos neovasos pueden llegar a contactar con el injerto. Estudios en modelo animal han identificado la NVC postqueratoplastia como un factor de riesgo de rechazo. El tratamiento de esta NVC en el postoperatorio mejora la supervivencia de los injerto en cornea de bajo como alto riesgo(2).
El Collaborative Corneal Transplantation Study (CCTS) definió “córnea de alto riesgo” como aquella con NVC en 2 o más cuadrantes antes de la cirugía; el riesgo aumenta con el número de cuadrantes afectados, de forma que la presencia de NVC en los 4 cuadrantes aumenta al doble el riesgo de rechazo, la gravedad de la respuesta inmune contra el injerto y se reduce el tiempo de aparición del eventual rechazo(7).
En estos casos, el tratamiento de NVC lo realizaremos para disminuir el riesgo de rechazo de una queratoplastia realizada o que planeemos realizar.
CLASIFICACIÓN DE LA NEOVASCULARIZACIÓN CORNEAL
Clasificación clínica:
- Grado 1: NVC periférica
- Grado 2: NVC periférica y en media periferia
- Grado 3: NVC moderada afectando a toda la córnea
- Grado 4: NVC masiva afectando a toda la córnea
En un intento de clasificación más reciente se recomienda además incluir otros parámetros para caracterizar la NVC(8):
- Fuente: conjuntiva, limbo o iris
- Localización: número de cuadrantes afectados
- Profundidad: superificial, estromal anterior o estromal profundo
- Longitud: afectación en periferia, media periféria o central
- Color: brillante, mate o blanco grisáceo
- Fuga: de lípido, edema corneal, hemorragias corneales
- Patrón vascular: recto, tortuoso o arborescente
Se asigna un score de 1 punto por cada cuadrante afecto, 1 punto si es NVC superficial y 2 si es NVC profunda. Se asigna 1 punto a la NVC periférica, 2 puntos a la NVC en media periferia y 3 puntos a la NVC central. En este estudio se vio que la causa más frecuente de queratopatía lipídica era la queratitis herpética
Según esta clasificación la NVC puede clasificarse en 5 estadios:
- Vasos activos jóvenes
Vasos llenos de sangre, brillantes, que avanza hacia la lesión en patrón arborescente, con red fina capilar y mínimo tejido fibroso perivascular. Suele presentar fuga lipídica y edema.
- Vasos activos antiguos
Los vasos alcanzan la lesión, cesando la proliferación pero consolidándose. Pierden brillo.
- Vasos maduros
Vasos grandes con mínima arborización y sin red capilar. Se suelen ver en lesiones que ya han curado, mantienen flujo constante.
- Vasos parcialmente regresados
Se ven cuando la lesión que los ha inducido ha cesado o han recibido tratamiento. Tienen flujo lento con zonas parcialmente obliteradas.
- Vasos regresados o fantasma
Vasos completamente regresados que se ven como líneas blancas dentro del estroma.
TRATAMIENTO DE LA NEOVASCULARIZACIÓN CORNEAL
Podemos dividirlo en dos categorías:
A. TRATAMIENTOS ANGIOSTÁTICOS/ANTIANGIOGÉNICOS:
Frenan el desarrollo de nuevos vasos inmaduros en crecimiento, pero es menos efectivo sobre vasos maduros bien establecidos, como apuntaba en el foro el Dr. Noé Rivero. Es decir, para producir la regresión de neovasos corneales inmaduros nos bastaría con bloquear el estímulo angiogénico, que es primordial para su mantenimiento y desarrollo. El problema puede venir, en ocasiones, en diferenciar los neovasos maduros de los inmaduros si no tenemos registros previos del paciente. En este grupo contamos principalmente con los fármacos antiinflamatorios e inmunosupresores y los fármacos que bloquean la acción del VEGF.
- Corticoesteroides
Su acción antiangiogénica se debe a su efecto inhibitorio sobre las células del sistema inmune, inhibiendo la síntesis de citocinas y la quimiotaxis, pero también actúan a nivel del endotelio vascular, inhibiendo su proliferación y migración. Los consideraremos como fármacos de 1º línea en presencia de inflamación activa, como por ejemplo en casos de queratitis herpética activa o NCV asociada con rechazo inmune en queratoplastia. La prednisolona y la dexametasona son las de mayor potencia antilinfangiogénica. Aunque la principal vía de administración es la tópica también se ha descrito la inyección de triamcinolona subtenoniana en el tratamiento de la NVC. La posología la prescribiremos en función de la gravedad, y lo habitual es ir disminuyendo la dosis a lo largo de meses. Deberemos monitorizar estrechamente a los pacientes para controlar los posibles efectos adversos oculares de los corticoides.
- Anti-inflamatorios no esteroideos (AINEs)
Tienen propiedades antiinflamatorias al inhibir la ciclooxigenasa 1 y 2. Aunque tienen capacidad potencial de bloquear factores angiogénicos, no existen hasta la fecha estudios que evalúen la eficacia de los AINEs en la prevención o el tratamiento de la NVC.
- Inmunosupresores
- Ciclosporina
Es un inhibidor de la calcineurina que bloquea la activación de los linfocitos T. De forma tópica se usa a concentraciones variables desde 0.05%. Su eficacia en el tratamiento de la NVC parece inferior a la de los corticoides, pero podría emplearse como ahorrador de los mismos en ciertos trastornos con base inflamatoria.
- Tacrolimus
Es otro inhibidor de la calcineurina mucho más potente que la ciclosporina. Suele emplearse en forma de pomada oftálmica a concentración de 0.03%. En modelos experimentales ha sido efectivo en la prevención de la NVC por vía tópica y sistémica.
- Ciclosporina
- Anti-VEGF
En la actualidad disponemos de varios fármacos que actúan como anti-angiogénicos (de vasos sanguíneos y linfáticos) bloqueando la acción del VEGF: bevacizumab (Avastin®), ranibizumab (Lucentis®), pegaptanib (Macugen®) o aflibercept (Eylea®).
El bevacizumab tópico off-label, anticuerpo monoclonal humanizado que bloquea VEGF-A, ha demostrado eficacia en el tratamiento de la NVC en modelos animales y en práctica clínica, en pacientes con mala respuesta a tratamiento anti-inflamatorio convencional. Se puede utilizar en dosis de 5 o 10 mg/mL 4-5 veces al día durante un mes y disminuir la dosis en función de la respuesta (Dr. Gegúndez). Aunque la tolerancia mostrada en estudios clínicos en general es buena, no debemos olvidar el papel trófico que tiene el VEGF sobre la superficie ocular, de forma que podemos tener alteraciones neurotróficas y epiteliales corneales, de la respuesta inmune normal corneal y retraso en la curación de erosiones.
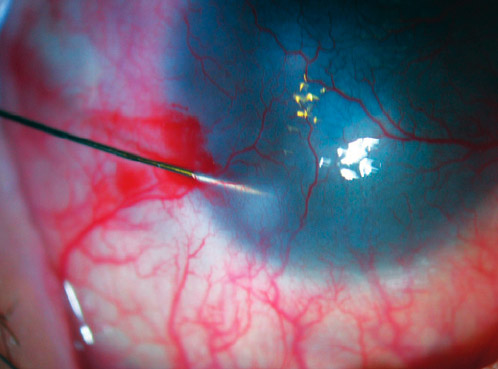
Bevacizumab también se puede utilizar en forma de inyecciones subconjuntivales o intraestromales de 0.1-0.3 mL a concentración de 25mg/mL (misma concentración que para vía intravítrea, Dr. Gegúndez). Esta vía podría tener un perfil de efecto adversos más baja, aunque puede ser necesario repetir las inyecciones tras varias semanas para obtener el efecto clínico deseado (Dr. Ulate, Dra. Abuin). En corneas neovascularizadas se ha visto que bevacizumab alcanza niveles estromales tanto por vía tópica como por vía subconjuntival.
El fármaco con mayor experiencia del grupo en NVC es el bevacizumab. En un metaanálisis acerca de la efectividad de bevacizumab en el tratamiento de la NVC, que incluía 7 estudios clínicos y 18 estudios en modelos animales, en los estudios clínicos se observó una reducción significativa del 36% del área de NVC en global, un 32% por vía subconjuntival y un 48% por vía tópica. El efecto era mayor cuando los neovasos corneales estaban activos que cuando eran estables: 59% de reducción del área de NVC vs 28%. En los estudios en modelos animales también se encontró una mejor diferencia media estandarizada de reducción de NVC del bevacizumab con respecto al control. El bevacizumab fue en general bien tolerado y no se reportaron efectos adversos significativos(9).
Aunque existen estudios clínicos y experimentales que han demostrado la efectividad de otros anti-VEGF (pegabtanib, ranibizumab o aflibercept) en el tratamiento de la NVC, algunos estudios comparativos han mostrado mayor efectividad del bevacizumab, por lo que parece razonable que sea el fármaco de elección dentro del grupo(1).
- Aganirsen: anti-insulin receptor substrate-1 (anti-IRS-1)
En varios modelos in vivo se ha visto que el insulin receptor substrate-1 (IRS-1) es un mediador clave en la angiogénesis inflamatoria. Aganirsen (GS 101) es un oligonucleótido antisentido con efecto antiangiogénico sobre vasos sanguíneos y linfáticos bloqueando la expresión de IRS-1 y disminuyendo la expresión de VEGF y de IL-1.
Ensayos clínicos controlados multicéntricos en fase 2 y 3 han demostrado que aganirsen tópico 1 gota cada 12 horas reduce significativamente el área de NVC, es seguro y bien tolerado y reduce la necesidad de queratoplastia en pacientes con NVC central asociada a queratitis. Sin embargo, no se encontró un aumento significativo de la AV. Se recomienda una duración de 3 meses de tratamiento, y el efecto perdura tras suspenderlo(10, 11). El principal inconveniente de este tratamiento es su elevado precio (es uno de los conocidos como “fármacos huérfanos”), aunque desde España se puede solicitar desde farmacia hospitalaria o comprarse al extrangero (Dr. García-Delpech).
- Inhibidores de metaloproteinasas (MMP)
Las tetraciclinas, como la doxiciclina o la minociclina, inhiben las metaloproteinasas que degradan la matriz extracelular favoreciendo la NVC. Se ha visto además que podrían tener un efecto antiangiogénico independiente de las MMP, pudiendo tener un efecto sinérgico con el de otros antiangiogénicos como en bevacizumab.
- Otros fármacos antiangiogénicos
- Inhibidores de multikinasas: sunitinib, sorafenib, lapatinib, pazopanib
- Inhibidores de la Rho kinasa: fasudil
Fuente: obs/Hoffmann-La Roche AG
B. TRATAMIENTOS ANGIOREGRESIVOS/ANGIOCLUSIVOS (QUIRÚRGICOS):
Regresión de vasos maduros ya establecidos. Los vasos maduros recubiertos de pericitos no dependen tanto del VEGF y de otros factores angiogénicos, por lo que para tratarlos adecuadamente necesitaremos añadir procedimientos físicos.
- Oclusión de neovasos corneales
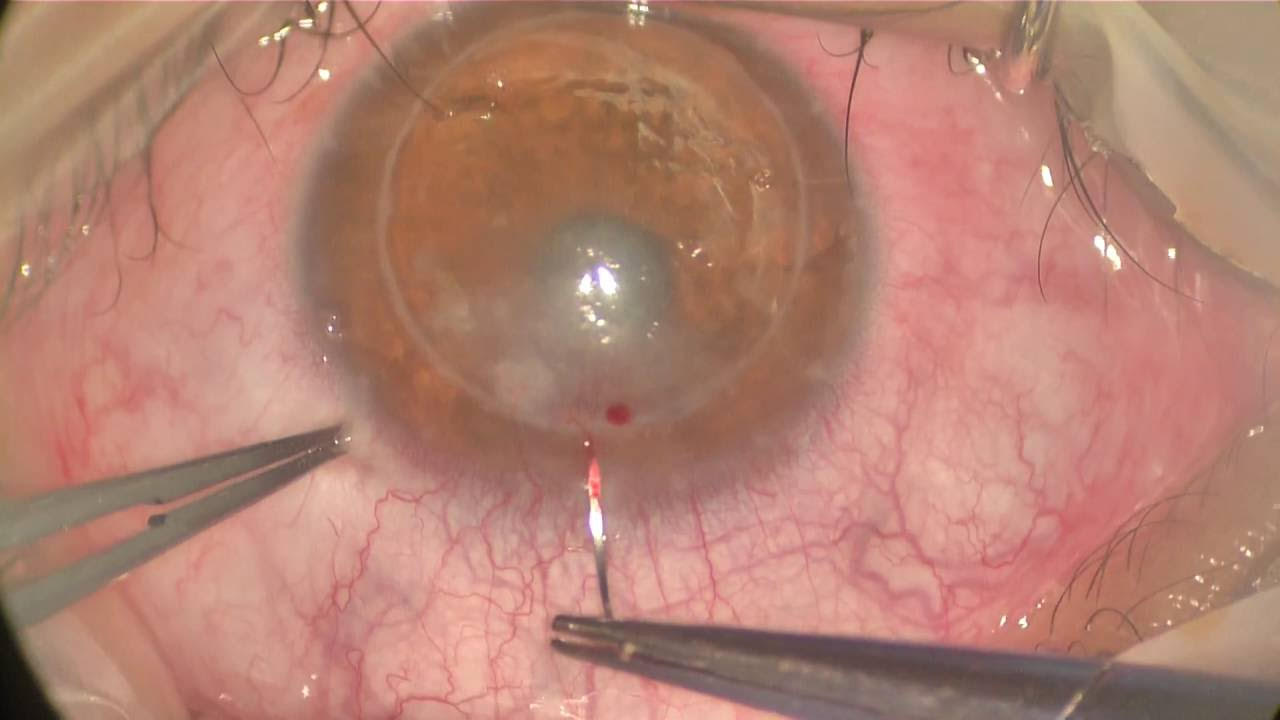
- Diatermia con aguja fina
Se utiliza el bisturí eléctrico habitual (cauterio monopolar) con la punta de colorado. La técnica consiste en pasar una aguja de nylon de 10-0 o de 9-0 lo más cerca posible de los troncos vasculares principales que queramos coagular. Se empieza dando toques muy cortos con la punta de colorado en la aguja hasta que se produce el blanqueamiento y oclusión del vaso. Se empieza desde el mínimo nivel de energía de coagulación (nivel 1 o 2) que iremos subiendo si fuera necesario. Para aumentar la eficacia se puede coagular en varios puntos un mismo vaso(12, 13).
La coagulación con aguja fina produce contracción y cicatrización del tejido corneal, de forma que deberemos aplicar la mínima energía posible para lograr el efecto deseado. Los tratamientos angioclusivos se pueden combinar con tratamiento antiangiogénico tópico o subconjuntival, lo que podría mejorar su efectividad. De esta forma el estímulo inflamatorio-proangiogénico producido por la propia coagulación podría ser contrarrestado por el tratamiento anti-angiogénico adicional (Dr. García-Delpech). En una serie en la que se combinó diatermia con aguja fina + bevacizumab tópico o subconjuntival en NVC madura se consiguió la regresión de los vasos nutricios en 14 de 16 casos con reducción significativa del área de NVC de 46%. No hubo mejoría significativa en la AV ni tampoco efectos adversos asociados al tratamiento(14).
En una serie retrospectiva de 17 ojos con queratopatía lipídica la diatermia con aguja fina consiguió la regresión de NVC en el 82% de los casos. En esta misma serie en 19 ojos de queratoplastia de alto riesgo con NVC, el pretratamiento con diatermia con aguja fina evitó la necesidad de queratoplastia en 6 casos y mejoró el pronóstico de supervivencia de los 13 restantes al 85% dentro del primer año. En 4 casos de queratoplastia con rechazo inmune, con NVC y mala respuesta al tratamiento convencional, la diatermia con aguja fina consiguió ocluir los vasos estromales ayudando a resolver el cuadro en todos los casos(15).
Nosotros hemos tenido buenos resultados tratando varios casos de NVC establecida previo a re-queratoplastia combinando diatermia con aguja fina y Bevacizumab subconjuntival-intraestromal, habiendo observado la regresión completa de la NVC en el postoperatorio en todos los casos. En una ocasión utilizamos el terminal de diatermia del facoemulsificador y se pudo constatar que no sirve para nada.
- Cauterización con láser argón o Nd:YAG
La cauterización de la NVC con láser láser argón o Nd:YAG produce disrupción y degeneración endotelial, formación de coágulos y distorsión de lamelas corneales al aplicar el laser sobre los vasos corneales. Es un tratamiento que ha mostrado eficacia en modelos experimentales y estudios clínicos. Se puede combinar con terapia antiangiogénica. Las complicaciones son hemorragia corneal, adelgazamiento corneal, exacerbación y recanalización de la NVC.
En un reciente estudio con láser Nd:YAG en NVC madura, tras 3 meses se observó una disminución del área de NVC de 32 a 17% con la oclusión completa del 53% de los vasos, oclusión parcial del 9%, mientras que el 37% de los vasos se recanalizaron(16).
- Otros tratamientos vasooclusivos
Algunas series de casos han mostrado la utilidad de la terapia fotodinámica con verteporfina en el tratamiento de la NVC. En un reciente estudio en modelo murino de NVC con suturas y posterior queratoplastia, el crosslinking con riboflavina redujo significativamente los neovasos maduros sanguíneos y linfáticos y mejoró la supervivencia de la queratoplastia a largo plazo con respecto al grupo control(17).
- Diatermia con aguja fina
- Reconstrucción de la superficie ocular
El trasplante de membrana amniótica es efectivo en la prevención de NVC asociada a daño agudo sobre la superficie ocular como en quemaduras químicas o en procesos como el síndrome de Steven-Jonhson.
La DCML deberemos tratarla mediante procedimientos de reconstrucción de la superficie ocular, que escapan al objetivo de esta revisión.
CONCLUSIONES
En resumen, la neovascularización corneal se produce cuando se da un disbalance entre los factores anti-angiogénicos y pro-angiogénicos corneales, jugando la inflamación un papel fisiopatogénico fundamental.
Para los neovasos corneales inmaduros activos en crecimiento, sobre todo en presencia de inflamación activa, el tratamiento de elección serán los corticosteroides tópicos y los fármacos anti-VEGF. Para el tratamiento de los vasos maduros establecidos deberemos añadir, además, tratamientos físicos vasooclusivos que se puede combinar con la terapia antiangiogénica, destacando entre todos ellos la diatermia con aguja fina por ser un tratamiento sencillo, barato, seguro y eficaz.
ADDENDUM: Preparación del colirio de Bevacizumab
BIBLIOGRAFÍA
- Roshandel D, Eslani M, Baradaran-Rafii A, Cheung AY, Kurji K, Jabbehdari S, et al. Current and upcoming therapies for corneal neovascularization. Ocul Surf. 2018.
- Reinhard T, Larkin F. Corneal Disease. Recent developmants in diagnosis and therapy: Springer; 2013.
- Dietrich T, Bock F, Yuen D, Hos D, Bachmann BO, Zahn G, et al. Cutting edge: lymphatic vessels, not blood vessels, primarily mediate immune rejections after transplantation. J Immunol. 2010;184(2):535-9.
- Le Q, Xu J, Deng SX. The diagnosis of limbal stem cell deficiency. Ocul Surf. 2018;16(1):58-69.
- Kim KH, Mian SI. Diagnosis of corneal limbal stem cell deficiency. Curr Opin Ophthalmol. 2017;28(4):355-62.
- Di Zazzo A, Kheirkhah A, Abud TB, Goyal S, Dana R. Management of high-risk corneal transplantation. Surv Ophthalmol. 2017;62(6):816-27.
- The collaborative corneal transplantation studies (CCTS). Effectiveness of histocompatibility matching in high-risk corneal transplantation. The Collaborative Corneal Transplantation Studies Research Group. Arch Ophthalmol. 1992;110(10):1392-403.
- Faraj LA, Said DG, Al-Aqaba M, Otri AM, Dua HS. Clinical evaluation and characterisation of corneal vascularisation. Br J Ophthalmol. 2016;100(3):315-22.
- Papathanassiou M, Theodoropoulou S, Analitis A, Tzonou A, Theodossiadis PG. Vascular endothelial growth factor inhibitors for treatment of corneal neovascularization: a meta-analysis. Cornea. 2013;32(4):435-44.
- Cursiefen C, Viaud E, Bock F, Geudelin B, Ferry A, Kadlecová P, et al. Aganirsen antisense oligonucleotide eye drops inhibit keratitis-induced corneal neovascularization and reduce need for transplantation: the I-CAN study. Ophthalmology. 2014;121(9):1683-92.
- Cursiefen C, Bock F, Horn FK, Kruse FE, Seitz B, Borderie V, et al. GS-101 antisense oligonucleotide eye drops inhibit corneal neovascularization: interim results of a randomized phase II trial. Ophthalmology. 2009;116(9):1630-7.
- HS D. High-Risk Kertaoplasty. Penetrating and Lamellar Keratoplasty II: Lamellar Keratoplasty and Advanced Procedures. iLearn Didactic Courses: ESCRS.
- Pillai CT, Dua HS, Hossain P. Fine needle diathermy occlusion of corneal vessels. Invest Ophthalmol Vis Sci. 2000;41(8):2148-53.
- Koenig Y, Bock F, Kruse FE, Stock K, Cursiefen C. Angioregressive pretreatment of mature corneal blood vessels before keratoplasty: fine-needle vessel coagulation combined with anti-VEGFs. Cornea. 2012;31(8):887-92.
- Faraj LA, Elalfy MS, Said DG, Dua HS. Fine needle diathermy occlusion of corneal vessels. Br J Ophthalmol. 2014;98(9):1287-90.
- Kumar J, Gehra A, Sirohi N. Role of Frequency Doubled Nd: Yag Laser in Treatment of Corneal Neovascularisation. J Clin Diagn Res. 2016;10(4):NC01-4.
- Hou Y, Le VNH, Tóth G, Siebelmann S, Horstmann J, Gabriel T, et al. UV light crosslinking regresses mature corneal blood and lymphatic vessels and promotes subsequent high-risk corneal transplant survival. Am J Transplant. 2018.
AUTOR

Javier García-Montesinos Gutiérrez
– Sección Córnea y Cirugía Refractiva, Qvision, Unidad de Oftalmología Hospital Vithas Virgen del Mar, Almería.
– Sección Córnea y Superficie Ocular, Complejo Hospitalario Torrecárdenas, Almería

4 Comentarios
Ines Ruiz
mayo 19, 2019Hola! Quisiera saber si para el tratamiento de un córnea vascularizada por queratitis herpética también son aplicables estás técnicas.
Javier García-Montesinos
mayo 20, 2019Estimada Ines,
Estos tratamientos se pueden usar para la tratar la neovascularización corneal producida por queratitis herpética, que es una de las principales causas de neovascularización corneal. Pero teniendo en cuenta que los corticoides y que la cirugía ocular en general, son factores que pueden inducir la reactivación de la queratitis herpética, le recomendaría añadir profilaxis antiherpética si se van a aplicar estos tratamientos, para disminuir el riesgo de reactivación.
Espero que pueda tratarse con éxito de su patología corneal.
Reciba un cordial saludo
Dr. García-Montesinos